Økonomisk Ugebrev havde fornøjelsen af at afholde Life Science Investor Konference den 23. april i sidste uge. Fedmemarkedet var et tema gennem flere af præsentationerne (Morten Larsen, Gubra og Tetra Pharm Technologies), mens onkologi var et tema hos Chosa Oncology og sluttelig hos Egetis Therapeutics var fokus på den meget sjældne sygdom MCT8-mangel, hvor man er på tærsklen til at begynde salget i Europa. Alle præsentationer og slides kan ses og downloades her: https://konferencer.ugebrev.dk/event/investor-konference-den-23-april/
Her følger en beretning fra dagen inkl. enkelte relevante tilføjelser, der ikke blev sagt i selve præsentationerne.
Fedmemarkedet – Morten Larsen
Indledningsvist gav aktieanalytiker Morten Larsen fra ABG Sundal Collier en opdatering på Health Care sektoren og tendenserne blandt særligt de danske selskaber. Et budskab var, at de danske selskaber er gået fra historisk at have været dyre kvalitetsselskaber til nu faktisk at være moderat prissatte ift. flere af deres internationale peers. Endda så meget så de internationale peers nu er højere prissat. Derudover er ”bear temaer” (patentkløfter, balancestruktur, etc.) igen blevet et tema blandt investorerne, som selvsagt også har fokus på de helt aktuelle temaer omkring told, supply chains, etc.
Mest imødeset var nok Morten Larsens betragtninger om fedmemarkedet, og hvordan fremtiden ser ud – særligt med udgangspunkt i Novo, hvis storsælgende Wegovy går af patent omkring 2031/2032, og potentielt vil 70 % af Novos omsætning være i fare. Det helt store spørgsmål, som lige nu optager investorerne, er overvejelserne om, hvordan markedet bliver fordelt i fremtiden mellem tabletter eller sprøjter/injektioner, for det ser lige nu ud til at være afgørende for, hvordan markedet bliver fordelt. Andre overvejelser går på prisudviklingen, og om det aktuelle prispunkt kan holde de næste mange år.
En ting er dog formentlig ganske sikkert, hvis man f.eks. tager udgangspunkt i introduktionen af Wegovy på det danske marked. Sjældent har man set en så hurtig penetrering af markedet, og det endda med et lægemiddel der for langt de fleste er selvbetalt og uden tilskud. Globalt er der over 1 mia. mennesker med BMI over 30, og heraf er der anslået over 175 mio. i ”højindkomstlande”.
Om Novo kan fastholde en flot markedsandel, er det store spørgsmål, som alle stiller sig selv lige nu. At dømme ud fra kursudviklingen i Novo, er det ikke umiddelbart forventningen, at Novo kan fastholde sin solide markedsposition, når de store konkurrenter kommer ind på markedet, og fokus måske flyttes over til tabletbaserede lægemidler.
Af Novos egne oplysninger kan det udledes, at de over en årrække vil skalere deres GLP-1 forretning til at kunne behandle et trecifret antal (mio.) patienter. I praksis indikerer det, at Novo reelt set forventer at gå fra 2 mio. fedmepatienter til over 60 mio. fedmepatienter, når kapaciteten er på plads. Når man samtidig tænker på, at Novo omsatte for 65 mia. DKK i sin fedmeforretning i 2024, er det enorme summer, der venter forude, hvis patientforudsigelserne holder. Behandlingsprisen vil dog være en modvirkende faktor.
Over de næste par år har Novo og Eli Lilly markedet for sig selv, og det stiller spørgsmålet, hvordan Novo skal prissættes, når man ved, at Wegovy går af patent, og 70 % af omsætningen da er i fare for at ryge, hvis ikke der kommer nye lægemidler fra pipelinen undervejs.
Morten Larsen drog en parallel til den svenske mastodont AstraZeneca, som også i slut 00’erne stod foran store patentudløb. Det fik investorerne til flere år i forvejen at handle aktien til en P/E omkring 6-8 stykker. I grove træk er det også der, hvor Novo handler lige nu, hvis man ser på den forventede indtjening i 2030.
Der fremkom ingen købs- eller salgsanbefaling eller kursmål på hverken Novo Nordisk eller andre af de aktier, der blev nævnt undervejs.
Tetra Pharm Technologies
Fra Tetra Pharm Technologies præsenterede CSO Morten Allesø, og fokus var mest på platformen og pipelinen og herunder selskabets førende fedmeprojekt TPT0701, der er i præ-klinisk udvikling.
Selskabets tilgang minder om Gubra med en serviceforretning (CDMO) og en forretning med egen R&D. Tetra Pharm Technologies’ tilgang er neurologisk, og deres platform bygger umiddelbart på en ide om eller koncept om ”polypharmacology”, dvs. at man forsøger at kombinere flere molekyler, så de samlet passer bedst til de receptorer eller targets, man gerne vil påvirke – eller undgå at påvirke. Den grove sammenligning er, at man kombinerer flere legoklodser, så de samlet kan bruges til bygge noget, ift. at en enkelt legoklods ikke i sig selv kan bruges til at bygge noget særligt eller spektakulært.
Grundlæggende er det Tetra Pharma Technologies’ udgangspunkt, at langt de fleste eksisterende lægemidler og behandlinger fokuserer på symptombehandling/-lindring fremfor at behandle de egentlige eller grundlæggende årsager til sygdommene.
Indenfor obesity/fedme betyder det meget konkret, at man ikke ser obesity som en metabolisk lidelse, men som en neurologisk lidelse. Med andre ord ligger den grundlæggende årsag til fedme oppe i hjernen og ikke i maven, hvor GLP-1’erne primært opererer.
Særligt slide 12 og 13 var i vores øjne interessante i forhold til synet på hele fedmemarkedet og de ulemper og bivirkninger, der også ligger ved brug af GLP-1erne. Her blev der bl.a. vist data fra et stort cohort-studie, der viste, at op mod 40 % af GLP-1 patienter efter 5 år har oplevet psykiske bivirkninger såsom angst, depression og selvmordstanker. Det er næsten dobbelt så højt som fedmepatienterne i kontrolgruppen, der ikke fik semaglutide eller forgængeren liraglutide (Victoza/Saxenda).
På kortere tidsperioder (6 mdr., 1 år, 3 år) er der også en højere risiko for psykiske bivirkninger hos GLP-1 patienterne. Morten Allesø oplyste også, at patienter ét år efter at være stoppet på semaglutide har taget 2/3 af vægttabet på igen ifølge et andet studie.
I det hele taget bliver bivirkningerne måske overset lidt i øjeblikket, hvor der er meget fokus på at opnå det største vægttab, mens bivirkninger som kvalme og opkast er særdeles fremtrædende. Det ledte direkte til det lidt mere filosofiske spørgsmål, om de høje bivirkninger alternativt kan ses som en terapeutisk effekt? Dvs. er medicinen reelt set et opkastfremkaldende lægemiddel (med vægttab som bivirkningen)? I fremtiden giver det ifølge Tetra Pharm Technologies mening at have større fokus på bivirkningsprofilen, og med det udgangspunkt blev TPT0701 præsenteret mere indgående. Det er 3. generation ”CB1R Antagonist/PR-2 Agonist”, som i modsætning til 1. og 2. generationslægemidlerne (bl.a Rimonabant fra Sanofi og Monlunabant fra Novo Nordisk) fokuserer på flere receptorer, således at man både forsøger at reducere appetitten, men også forsøger at behandle den hormonelle ubalance, der forårsager fedme. Kombinationen af de aktive molekyler bør også medføre betydelig færre af psykiatriske bivirkninger, der fik eksempelvis Rimonabant trukket tilbage fra markedet.
Lidt populært sagt mener Tetra Pharm Technologies, at TPT0701 er designet til et maraton og ikke en sprint. Heri ligger også implicit et syn på det førnævnte overdrevne fokus på det højest/hurtigst mulige vægttab, fremfor en erkendelse af, at fedme måske er mere kronisk i sin natur og kræver længerevarende behandling af de grundlæggende årsager, for at få et sundt og permanent holdbart vægttab.
Børsnotering på vej?
Mere overordnet blev det også nævnt, at Tetra Pharm Technologies netop har fået tilladelse fra EMA til at opstarte sit første kliniske fase 1 studie med deres lægemiddelkandidat mod kronisk smerte. Og der er også fremskridt i selskabets nye facilitet i Ølstykke, hvor Lægemiddelstyrelsen for nylig har lavet sin inspektion, og denne 10x større facilitet er nu godt på vej til at kunne tages i brug.
I modsætning til tidligere stiler Tetra Pharm Technologies nu efter en børsnotering senere i år, uden at det dog kunne præciseres nærmere hvor, hvornår, etc. Det er en ændring ift. præsentationen i efteråret 2024, hvor man indikerede en 2-3 års plan, der ellers først skulle munde ud i en børsnotering i 2026 eller 2027.
Vi kan altså formentlig se frem til, at Tetra Pharma Technologies måske bliver et interessant børsnoteret bekendtskab senere i år. Det kan kun tiden vise, og det afhænger selvsagt af udviklingen i markedet, investorinteressen, m.v., for vi skal heller ikke glemme, at man i langt overvejende grad er et præklinisk selskab, hvor der stadig er lang vej til markedet.
Download præsentationen her eller se hele præsentationen på https://konferencer.ugebrev. dk/event/investor-konference-den-23-april/
Gubra
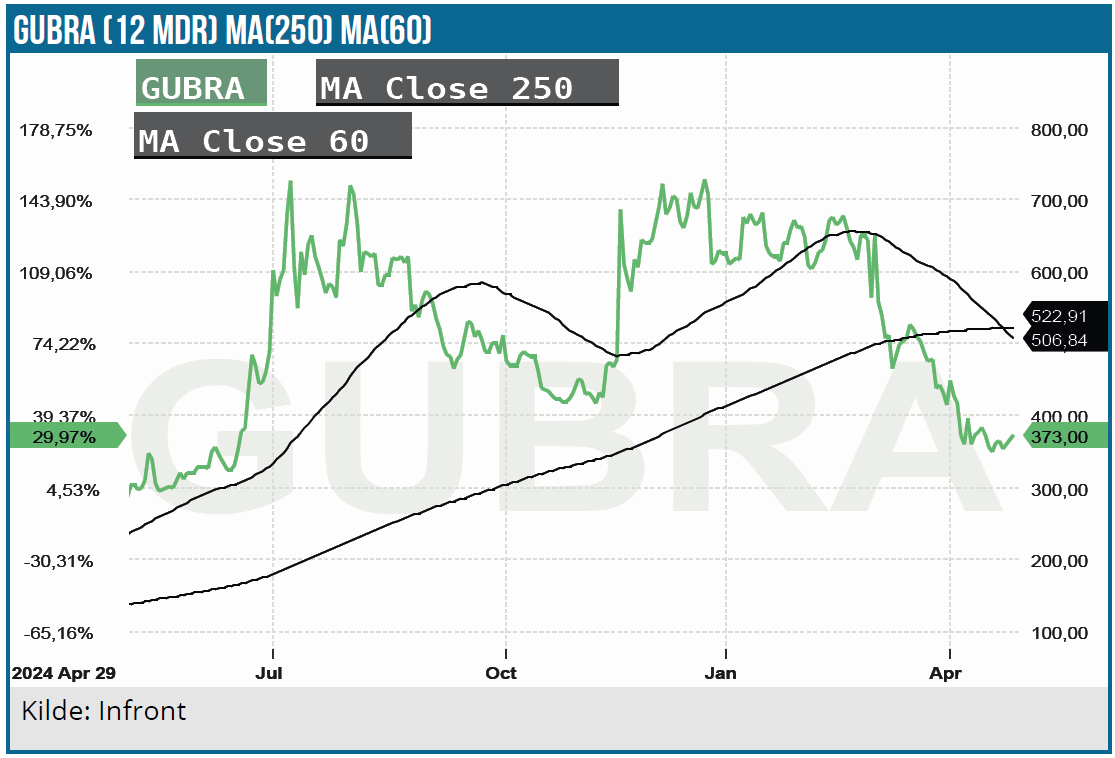
For Gubra præsenterede CFO Kristian Borbos, og fokus var ikke overraskende på den flotte partneraftale, man præsenterede i marts måned med big pharma selskabet AbbVie på amylinprojektet GubAmy, der med Kristian Borbos’ ord er selskabets kronjuvel.
Amylinbaserede vægttabsmidler spås af flere til at blive næste generations fedmelægemidler, der både kan tages alene eller i kombination med andre lægemidler. Gubras amylinprojekt har lang patentlevetid og umiddelbart den længste halveringstid (1½ uge) blandt de kendte amylinprojekter.
Aftalen med AbbVie giver 350 mio. USD i upfrontbetaling foruden løbende milepælsbetalinger på 1,875 mia. USD (klinisk og kommercielle) og trinvise royalties, hvis amylinprojektet når på markedet.
Hele projektet bliver snart overleveret til AbbVie, og al rapportering er også deres ansvar nu. Derfor var det ikke meget, CFO Kristian Borbos kunne sige yderligere om amylinprojektet. Eksempelvis bliver de kommende data fra Part B (12 ugers behandling) i MAD-studiet nu rapporteret af AbbVie.
Trods ihærdige forsøg under spørgsmål/svar-sessionen lykkedes det ikke at få flere detaljer om AbbVie-aftalen, herunder ikke engang en nærmere indikation af niveauet for royalty-satsen (f.eks. encifret eller tocifret procentsats), udover en kommentar om, at man har store forventninger til det fremtidige marked, hvorfor royalty-satsen har været en vigtig faktor i forhandlingerne med AbbVie.
Gubra har et stort fokus indenfor fedme i både sin egen R&D-forretning, men også i sin serviceforretning, hvor man laver kontraktforskning for en række store pharmaselskaber.
Udover amylin-projektet har man også aftaler med Boehringer Ingelheim og i sin egen portefølje fremhævede man UCN2-projektet, som stadig er i præklinisk udvikling. Fokus er her på kvaliteten af vægttabet, for med dagens GLP-1 midler vil 20-40 % af vægttabet typisk være muskelmasse (”lean mass”), hvilket måske på sigt ikke er noget, der foretrækkes af patienterne. Med UCN2 har rotteforsøg vist, at lean mass vægttabet stort set kan elimineres, samtidig med at der opnås en fedtreduktion (”fat mass”).
Gubra forventer at starte fase 1 forsøg i slutningen af 2025 eller i starten af 2026 med UCN2, hvorefter det ligesom med GUBamy er planen at udlicensere det til en stor pharmavirksomhed.
I Q&A-sessionen blev der ikke svaret nærmere på, hvad man skal bruge alle de mange penge på, udover at man vil skrue op for R&D-forretningen og gerne blive stærke indenfor et nye R&D-område (f.eks. Women’s Health).
Med en markedsværdi på ca. 6 mia. DKK og 500 mio. DKK i kassen plus AbbVie-betalingen på over 2 mia. DKK er der nu masser af penge i kassen til mange års drift og udvikling. Næsten så mange, at det er umuligt at bruge dem, medmindre der virkelig skrues op for udviklingsprojekterne. Sker det, ændrer Gubra dog også risikomæssig profil og vil næsten da være at betragte som et rendyrket biotechselskab, fordi serviceforretningens betydning vil blive meget mindre.
Gubra går en spændende fremtid i møde med AbbVie-partnerskabet, UCN2-perspektiverne og en solid pengekasse. Spændende bliver det at se, hvor meget der skrues op for udviklingsomkostningerne, og hvordan investorerne ser på det.
CHOSA Oncology
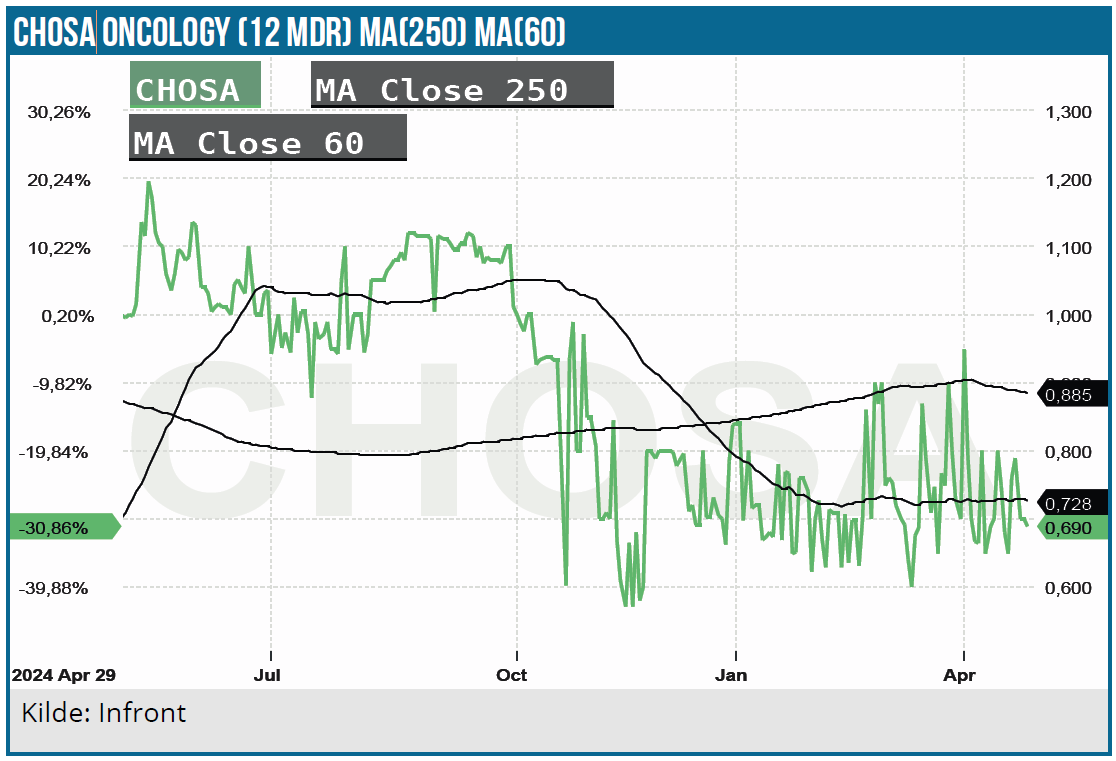
For CHOSA Oncology præsenterede Chief Business Officer & Co-founder Claus Frisenberg Pedersen. Selskabet fokuserer indenfor onkologi-området, mere specifikt immunterapi-området, hvor nogle af de mest sælgende lægemidler findes, f.eks. Keytruda, Opdivo, m.fl.
Selskabet vil kunne hjælpe lægen med at finde det rette lægemiddel, hvilket er relevant, fordi en stor del af kræftpatienterne i dag behandles med et lægemiddel, der ikke har effekt. Til det formål har selskabet udviklet en Drug Response Predictor (DRP), som er en multigen mRNA algoritme, der kan forudsige effekten af den mest udbredte kemoterapibehandling cisplatin.
CHOSA har i sin DRP identificeret 205 gener, som er med til at bestemme, om patienten har gavn af cisplatin. 100 af generne siger noget, om patienten er sensitiv, mens 105 gener siger noget om patientens resistens.
Hvis det hele lyder lidt bekendt, er det fordi, CHOSA bygger på teknologien fra det tidligere Oncology Ventures, som i dag hedder Allarity Therapeutics og er noteret i USA. Faktisk blev teknologien i CHOSA købt ud af Allarity Therapeutics ved flytningen til USA, og i dag samarbejder man derfor med Allarity og deler bl.a. et laboratorium i Hørsholm.
CHOSAs forretningsidé er i modsætning til de tidligere selskaber (og ved CHOSAs start) ikke at sælge sit eget lægemiddel. I stedet er det tanken, at man kan hjælpe et af de mange immunterapiselskaber, som har en PD(L)-1, der pt. ikke kan stille noget op i konkurrencen mod Keytruda og de få andre dominerende spillere, der sidder på rundt regnet 90 % af markedet.
Ved at udvælge patienter, der får gavn af cisplatin-behandling, kan CHOSA nemlig også øge PD(L)-1 lægemidlets effekt i kombinationen med cisplatin. I eksemplet på slide 10 i præsentationen ses en forbedring i effekten (målt som ”tumor eradication”) fra 24 til 44 % indenfor lungecancer, når der udvælges de rigtige patienter i forhold til ikke-udvalgte patienter, som får både cisplatin og en PD(L)-1’er. Dermed er det håbet, at evnen til at vælge de rigtige cisplatin-patienter kan være den differentierende egenskab, der kan løfte en eller flere af de mange små PD(L)-1 spilleres markedsandel fra næsten ingenting og til en mere betydende markedsandel. Med DRP’en udvælges f.eks. kun 1/3 af patienterne til behandling, og hos en markedsleder med f.eks. 66 % markedsandel giver det ikke finansiel mening at behandle færre patienter (fremfor ”alle”).
CHOSA viste et regneeksempel, hvor et PD(L)-1 salg på 1 mia. USD veksles til en 5 % royaltysats til CHOSA, svarende til 50 mio. USD om året. Tidshorisonten i eksemplet var uklar.
CHOSA forventer senere i år at få data fra et KOL-studie i lungecancer (i 2. kvartal) baseret på data fra Schweiz, hvor biopsier fra lungecancer-patienter bliver ”testet” med DRP’en. Sidst på året er der flere data, hvorefter man vil starte en FDA-proces og også begynde mere alvorlige samtaler med eventuelle partnere.
Selskabet arbejdet med et cash burn på 5-6 mio. DKK om året.
Egetis Therapeutics
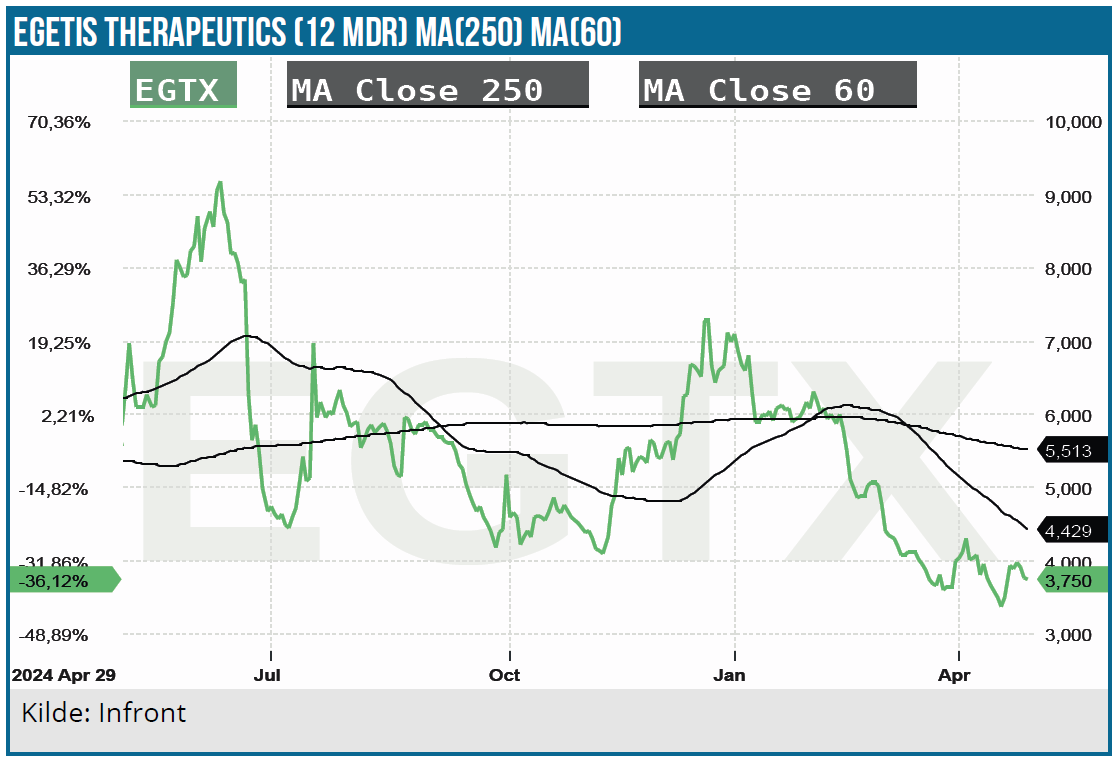
Head of investor relations Karl Hård, med en fortid i bl.a. AstraZeneca, præsenterede for Egetis Therapeutics, der netop i februar har fået EU-godkendelse af sit lægemiddel Emcitate til behandling af den meget sjældne sygdom MCT8-deficency. Selskabet står dermed på tærsklen til kommerciel lancering, der begynder i Tyskland i maj.
Egetis har lige nu ca. 230 patienter i såkaldte Early Access Programmer, hvor der bliver betalt lave priser for lægemidlet inden godkendelse. Lægemidlet udskrives typisk kun af læger til patienter, der har været med i de kliniske studier.
Prævalensen af MCT8-mangel ligger omkring 1 ud af 70.000 drengebørn, og medianalderen ved diagnosticering er 10 måneder, mens symptomerne typisk træder frem efter 4 måneder. I det hele taget er MCT8-mangel en meget sjælden sygdom, så der ligger et stort og vigtigt arbejde for Egetis i at få udbredt kendskabet til sygdommen, så flere bliver diagnosticeret rigtigt. Studier viser, at der er en større effekt af lægemidlet jo tidligere, det gives, og i udgangspunktet er det tiltænkt, at patienterne skal tage lægemidlet altid. Ifølge Karl Hård ligger der dog formentlig en udfordring i at få payors/sygekasserne til at betale for den langsigtede benefit.
Efter EU-godkendelsen i februar står den første lancering i Tyskland nu lige for døren, og det sker samtidig med, at pris- og tilskudsforhandlingerne køres sideløbende, således at der foretages en bagudrettet regulering, når der foreligger en endelig pris om ca. et års tid. Den tyske proces for tilskud- og prisforhandling kører i en stram og fastlagt proces.
Omkring pricing i USA oplyste Karl Hård, at deres market research indikerer, at andre sjældne sygdomme har kunnet opnå priser på 5-700.000 USD. Uden at det direkte blev nævnt som eksempler, kan vi her på ØU Life Science redaktionen tilføje, at lægemidler indenfor f.eks. de sjældne (børne-) leversygdommene Alagilles Syndrom eller PFIC, havde lanceringspriserne hos både Mirum og Albireo (nu opkøbt af Ipsen) i underkanten af 400.000 USD årligt. En anden og meget sjælden sygdom er Progeria, hvor der kun lige antages at være ca. 400 patienter på verdensplan, hvoraf man har identificeret ca. halvdelen. I USA er der formentlig kun lige over 20 patienter og lægemidlet Zokinvy kostede omkring 650.000 USD per år ved lanceringen.
Karl Hård oplyste, at man i USA har identificeret over 100 patienter, som antageligt vil kunne konverteres til betalende patienter efter en godkendelse. I det hele taget er det det amerikanske marked, der er det klart mest interessante for Egetis Therapeutics og dermed også for investorerne.
Egetis forventer at indsende en ansøgning til FDA senere i år, når det 16 patienter store (lille) amerikanske fase 3 studie er gennemført. Status er (opdateret med denne uges kvartalsregnskab), at 19 patienter pt. er inkluderet i studiet, hvoraf 11 har gennemført den randomiserede 30 dages periode som leder op til udmåling af det primære endpoint. Yderligere 3 patienter er i ”run-in” perioden, som går forud for de 30-dages randomiseringsperiode. Studieresultatet kan udlæses, når 16 patienter har gennemført randomiseringsperioden, og på præsentationens slide 7 findes en oversigt over studiet.
Ved en evt. FDA-godkendelse vil Egetis være berettiget til en Priority Review Voucher, som baseret på de seneste handler kan have en værdi på op til 150 mio. USD. Selskabet skal dog dele provenuet med tidligere licenshavere til Emcitate – hvilket dog ikke blev nævnt i løbet af selve præsentationen.
Med et burn på rundt regnet 300 mio. SEK i år skal der hentes yderligere kapital på et tidspunkt, enten i form af lån eller ny aktiekapital.
Steen Albrechtsen