Onsdag i denne uge annoncerede Hansa Biopharma de vigtige ConfIdeS imlifidase fase 3 data, som skal bane vejen for godkendelsen af imlifidase på det vigtige amerikanske nyretransplantationsmarked. Resultatet var positivt og betyder, at imlifidase sandsynligvis får FDA godkendelse i enten 3. eller 4. kvartal 2026, og kommercialiseringen i USA glider formentlig noget lettere, end det har været tilfældet i Europa.
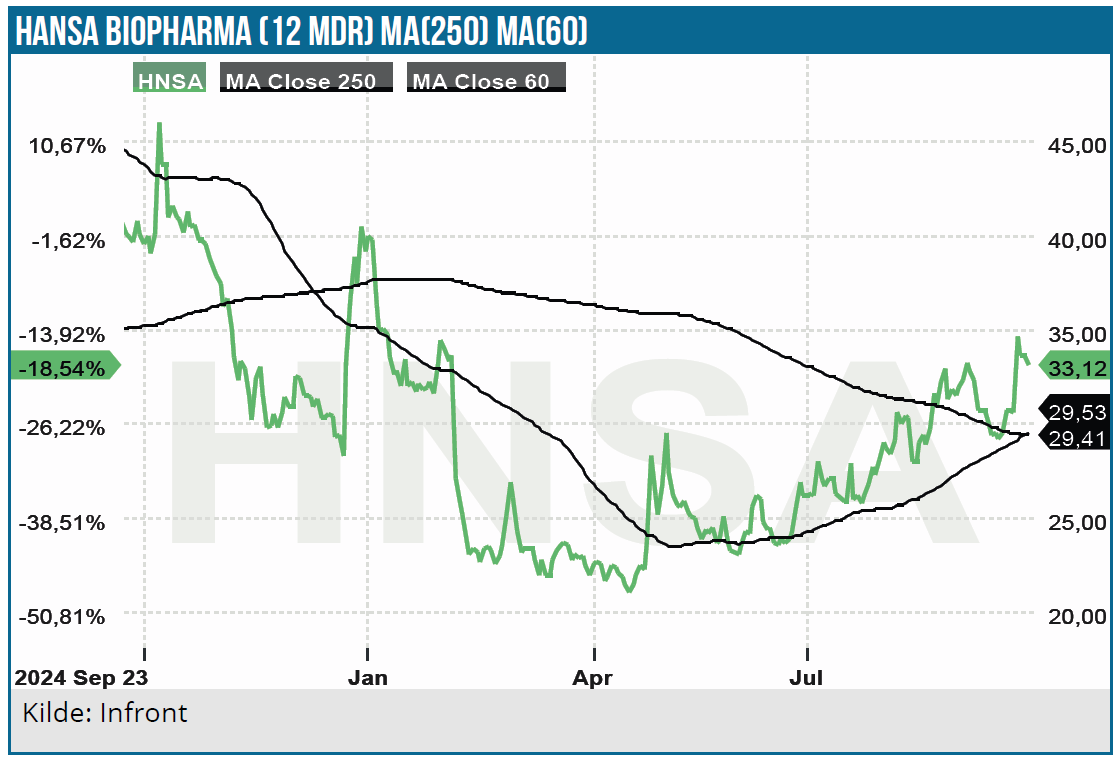
Efter de positive ConfIdeS data kvitterede aktiemarkedet med en kursstigning på godt 11 %, efter at kursen tidligere på dagen var oppe med over 30 %.
ConfIdeS var et relativt lille open label studie med 64 nyretransplantationspatienter, ligeligt fordelt med 32 patienter behandlet med imlifidase og 32 patienter i kontrolarmen, som modtog anden behandling med henblik på nedbringelse af risikoen for organafstødning. Det primære kliniske endpoint var nyrefiltreringsevnen efter 12 måneder (eGFR), og her var nyrefunktionen væsentligt bedre i den imlifidase behandlede gruppe med eGFR 51,5 ml/minut mod 19,4 ml/minut i kontrolgruppen.
Resultatet var statistisk signifikant, omend styrken af en statistisk test i så lille en patientgruppe altid kan diskuteres. Men forskellen i effektiviteten giver helt åbenlyst klinisk mening, ikke mindst når der her var tale om meget sensibiliserede patienter (cPRA på 99,9 %+), dvs. patienter som pt. har meget ringe muligheder for at få en ny nyre.
Den kliniske effekt i studiet er så markant, at vi regner det for næsten sikkert, at imlifidase får FDA godkendelse. Hvor vi tidligere estimerede en sandsynlighed for FDA-godkendelse på 70 % løftes estimatet til 90 %.
FDA-ansøgning i år
Hansa Biopharma forventer at indsende en BLA Accelerated Approval godkendelsesansøgning til FDA ultimo året. Hvis den accepteres, kommer FDA-afgørelsen efter 8 måneder inklusive en 2 måneders valideringsperiode. Hvis det derimod ender med en standard FDA godkendelsesprocedure, er sagsbehandlingens varighed 12 måneder. Imlifidase har derfor udsigt til godkendelse senest ultimo 2026.
Behovet for et produkt som imlifidase er stort i et amerikansk marked, hvor 9.000 nye højt sensibiliserede nyrepatienter kommer på venteliste for transplantation hvert år. Det ultra-højt sensibiliserede patientsegment svarende til dem i ConfIdeS studiet (cPRA på 99,9 %+) er relativt begrænset og ifølge Hansa Biopharma på ca. 3.500 patienter, men målgruppen for imlifidase bliver formentlig noget større.
Bliver USA en kommerciel succes?
Selvom imlifidase højst sandsynligt får godkendelse, er spørgsmålet, om kommercialiseringen bliver en succes. Kommercialiseringen i Europa har mildest talt været skuffende. Der er dog udsigt til, at det kommer til at gå noget bedre i USA med en mere effektiv fælles organcentral og et marked, som er modtageligt for ny effektiv medicin.
Hansa Biopharma har kommercialiseringsstrategien på plads og forventer et salgsteam på 20 fuldtidsansatte i USA. Medicare står for ca. 55 % af nyretransplantationsmarkedet. Det er meget sandsynligt, at imlifidase får Medicare accept, men spørgsmålet er, hvad de vil betale for en behandling.
Investeringscasen er interessant for den langsigtede investor, som tror på succes i USA. På den korte bane belastes investeringscasen af den skuffende performance på det europæiske marked og få kurstriggere, herunder forventede GBM data i 4. kvartal i år. Kursmålet på 12 måneders sigt løftes fra tidligere 70 SEK til 80 SEK.
Kurs på analysetidspunkt: 37 SEK
Kursmål 12 mdr.: 80 SEK
Analysedato: 25. september 2025
Lars Hatholt
Disclaimer: Læs her om ØU’s aktieanalyser.


Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her