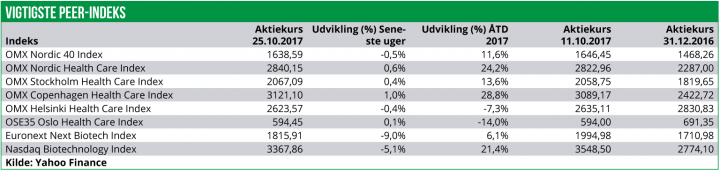
Den positive stemning er bevaret i den nordiske Healthcare sektor over de seneste 14 dage. Indekset er således steget med yderligere 0,6%. Det er igen den danske sektor, der driver fremgangen med en stigning på 1,0%, drevet af Novo Nordisk som har modtaget en positiv anbefaling i USA for et meget vigtigt pipeline-præparat.
Også det svenske Healthcare indeks har performet hæderligt og er steget med 0,4%. Det norske indeks ligger stort set uforandret med en stigning på 0,1%, mens det finske indeks er faldet med 0,4%.
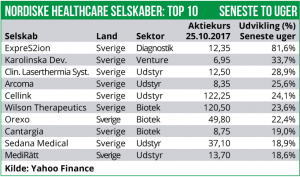
Den klart største stigning blandt enkelt-aktierne finder vi hos ExpreS2ion med en stigning på hele 82% efter at man har opnået proof-of-concept i en præklinisk brystkræft vaccine-model.
Herudover er der også en fremgang på 34% til den svenske Lifescience fond Karolinske Development, som på det seneste har fået børsnoteret et par af dets portefølje-selskaber.
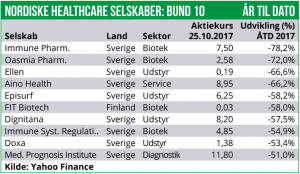
Immune Pharmaceuticals står for det største fald (-44%) efter at man har foretaget en emission, som kraftig udvander de eksisterende aktionærer. Til gengæld rejser emissionen så også et kapitalberedskab på ca. 18 mio. USD før transaktionsomkostninger.
AstraZeneca har meddelt, at FDA har accepteret at gennemgå selskabets indsendte registreringsansøgning for PD-L1 antistoffet Imfinzi (durvalumab). Ansøgningen er baseret på positive fase III resultater i locally-advanced stage III NSCLC patienter, som er sygdomsstabile efter forudgående behandling med planitum-baseret kemostråleterapi. Ansøgningen er baseret på positive PFS-data, som viste en forlængelse fra 5,6 måneder i placebo-armen til 16,8 måneder i Imfinzi-armen, svarende til en risikoreduktion på 48%. (p<0,0001). Tidligere på efteråret har AstraZeneca indsendt en tilsvarende ansøgning til de europæiske sundhedsmyndigheder. FDA har nu ligeledes accepteret at behandle AstraZenecas ansøgning for PARP-hæmmeren (Poly ADP-Ribose Polymerase) Lynparza i HER2 negativ BRCA-muteret metastatisk brystkræft. Samtidig er Lynparza tildelt såkaldt Priority Review status, hvilket betyder, at FDA vil behandle ansøgningen inden for 6 måneder og dermed med en beslutningsdato i løbet af 1. kvartal 2018. I Japan har AstraZeneca og partneren MSD Merck ligeledes indsendt en registreringsansøgning, og her ventes de japanske myndigheder at træffe en afgørelse i 1.halvår 2018. For diabetes type 2 GLP-1 once-weekly medikamentet Bydureon har FDA også godkendt en ny type device-system som mulighed en mere glidende frigivelse af det aktive stof. I kliniske studier har dette vist sig at føre til en reduktion i blodsukkeret på 1,4% samt et gennemsnitligt vægttab på 1,4 kg efter 28 uger. AstraZenecas aktiekurs har reageret positivt på den positive strøm af regulatoriske nyheder og er steget med 1% de seneste to uger. Dermed er aktien i et plus på 13% for hele året.
Genmabs partner Janssen har offentliggjort 3.kvartal 2017 salgstallene for CD38-antistoffet Darzalex i Multiple Myeloma. Det totale globale salg landede på 317 mio. USD, hvoraf 240 mio. USD er relateret til det amerikanske marked og de resterende 87 mio. USD til salget i resten af verden. I sidstnævnte tal er fratrukket en engangs-betaling på 20 mio. USD relateret til tilskuds-rabatter på det franske og tyske marked. Vores vurdering er at Darzalex-salget fortsat er en smule til den skuffende side, hvilket markedet da også har straffet Genmab-aktien for. Vi vurderer dog fortsat at salget af Darzalex vil fortsætte med at stige meget voldsomt på den lange bane og med forøget styrke i takt med at antistoffet tages i brug som første linje behandling, hvilket for alvor ventes at ske i 2018 og fremefter. Genmab-aktien er faldet med 9% og er dermed nu i et plus på 10% siden årsskiftet.
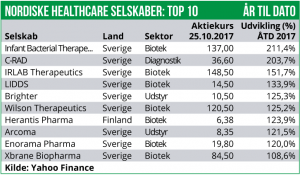
Herantis Pharma vil gennemføre en mindre rettet emission til en række professionelle investorer med henblik på at finansiere fase II studierne med Lymfactin i sygdomsindikationen Sekundær lymfødem. Sekundær lymfødem skyldes blokering af lymfebanerne pga. infektion, cancer eller posttraumatisk. Den mest typiske komplikation er postmastektomi-syndromet, dvs. hævelser i arme hos kvinder, som er opereret og evt. strålebehandlet for brystkræft. I alt udbydes 0,8 mio. stk. nye aktier til en tegningskurs på 5,85 EUR per aktie. På nuvæ-rende tidspunkt er den rettede emission allerede stort set 100% garanteret. Provenuet ventes derfor at blive på 4,68 mio. EUR før transaktionsomkostninger. Med kapital-rejsningen vurderer Herantis Pharma at have sikret kapitalberedskabet frem til og med 2019, hvor fase II studierne med både Lymfactin samt CDNF i Parkinsons sygdom ventes at være afsluttede. Gennemførelsen af emissionen er dog betinget af godkendelse på en ekstraordinær generalforsamling, hvilket vi dog ikke vurderer, vil blive et problem for selskabet at få i hus. Herantis Pharma aktien er faldet med 2% men er fortsat i +124% for 2017.
Medivir har præsenteret resultaterne fra fase IIa studiet med MIV-711 som et late-breaknig abstract på konferencen Annual Meeting of the American College for Rheumatology. MIV-711 blev i studiet testet i 244 patienter med moderat slidgigt i knæene. Selvom studiet ikke opfyldte det primary endpoint om at vise en smerte-reduktion efter 26 uger, vurderer vi at resultaterne er meget solide. Således sås 65% (p<0,005) mindre progression i slidgigten på knæet i forhold til placebo og samtidig sås 70% mindre tab af brusk i knæet i forhold til placebo. Som før nævnt missede forsøget dog det primære målepunkt, som var en reduktion i smerterne målt på Numerical Rating Scale (NRS) efter 6 måneders behandling. Dos sås en klar trend i retning af færre smerter målt via NRS for MIV-711 i forhold til placebo. Medivir arbejder fortsat på at iværksætte nye studier med MIV-711 og med længere varighed, men selskabet vil formentlig gennemføre studierne i samarbejde med en partner, da Medivir ønsker at fokusere sine ressourcer inden for kræftsygdomme. Den 24.oktober er MIV-711 af FDA desuden tildelt Fast Track Status, hvilket gives til lægemidler, som potentielt vil kunne dække et udækket medicinsk behov. Dette skønnes MIV-711 at kunne have ved tilsyneladende at have sygdomsmodificerende egenskaber på knoglestrukturen i slidgigt patienter. Medivir har også præsenteret resultater fra HDAC-hæmmeren Remetinostat, et kræftmiddel til behandling af Cutaneous T-cell Lymphoma (CTCL) af typen Mycosis Fungoides (MF). I studiet behandledes 60 patienter med forskellige doser og intervaller. Der sås en klar dosisafhængig respons, og på det højeste dosis niveau (1% gel Remetinostat 2 gange dagligt) sås en responsrate på 40% samt reduceret kløen (pruritus) i 80% af patienterne. Medivir vil nu afholde møder med FDA/EMA og derefter starte afsluttende fase III studier med Remetinostat i CTCL MF-typen. Vi vurderer resultater som ganske pæne, dog var den komplette responsrate lav, og hovedparten af respons var dermed partielle. Medivirs aktiekurs er steget med 6%, men aktien er fortsat i -29% siden starten af året.
Nexstim har rejst et provenu på 1,75 mio. EUR gennem udstedelse af aktier til den London baserede investor City Financial. I alt udstedes 7 mio. nye aktier til en tegningskurs på 0,25 EUR per aktie. Med kapitalrejsningen vurderer Nexstim, at der er tilstrækkelig kapital til at få selskabet igennem 1.kvartal 2019. Nexstim forventer i den nærmeste fremtid at indlede kommercialiseringen af dets NBT-system, som en behandling mod depression, slagtilfælde (stroke) og smerte i USA og Europa. I USA er NBT dog ikke godkendt endnu, men man afventer FDA-godkendelse i depression og der er desuden iværksat et nyt fase III studie (E-FIT studiet) i stroke indikationen i USA, hvorfra der ventes resultater i 2.kvartal 2018. Nexstim-aktien er steget med 13% og er nu i +73% for hele året.
Novo Nordisk har på et FDA Advisory Committee møde afholdt d. 18.oktober fået opbakning til godkendelse af GLP-1 once-weekly medikamentet Semaglutide til behandling af diabetes type 2. Med stemmerne 16 for og 0 imod har ekspertpanelet vurderet, at Semaglutide opfylder både effekt og sikkerhedskriterier for godkendelse. En endelig FDA-godkendelse ventes nu inden udgangen af 4.kvartal 2017, og vil nu med meget stor sikkerhed være positiv således, at Novo Nordisk kan påbegynde markedsføring af Semaglutide i USA i løbet af 1.kvartal 2018. Ligeledes er Semaglutide registreringsansøgninger indsendt til de europæ-iske og japanske sundhedsmyndigheder under behandling. Vi vurderer fortsat, at Semaglutide har et peak-sale potentiale på op imod ca. 5 mia. USD årligt. Semaglutide vil efter vores vurdering dermed blive den absolut vigtigste vækstdriver for Novo Nordisk over de kommende år. Novo Nordisks aktiekurs er steget med 3% og er i +25% siden årsskiftet.
Photocures blåt lys kontrastvæske Cysview, til opdagelse af blære-cancer, er i øjeblikket under registrerings-behandling hos FDA. I sidste uge accepterede FDA selve Cysview-ansøgningen og har tildelt Cysview Priority Review status. Cysview er i forvejen godkendt i USA, men ikke i det vigtige markeds-overvågningssegment, som har et betydeligt omfang, da der foretages mange rutinemæssige scanninger for blærekræft. En relativ hurtig godkendelse af Cysview i dette markedssegment er nu meget sandsynlig. Cysview har i et klinisk fase III studie påvist at kunne øge opdagelse af aggressive former for blærekræft med hele 44% i forhold til den hidtidige scannings-standard med hvidt lys kontrastvæske. Photocures aktien er steget med 2%, men er fortsat i -26% her i 2017.
Wilson Therapeutics er nået til enighed med FDA og EMA omkring forsøgsprotokollen for et afsluttende fase III forsøg med WTX101 (bis-choline tetrathiomolybdate) i den genetiske sygdom Wilsons disease. Wilsons sygdom (hepatolentikulær degeneration) er en autosomal recessiv stofskiftesygdom, der skyldes en enzymatisk fejl i udskillelsen af kobber til galden. Hvis sygdommen ikke behandles, kan den medføre livstruende skader på leveren samt hjernen med neurologiske og psykiske/psykiatriske forstyrrelser. Fase III studiet med arbejdstitlen FOCuS vil optage ca. 100 patienter, som behandles dagligt med WTX101 over 48 uger. Forsøgets primary endpoint vil være kobber-kontrol ved uge 48 i forhold til baseline-scoren. Sekundære endpoints omfatter blandt andet udviklingen i neurologiske, psykiske og fysiske symptomer samt generel livskvalitet i forhold til baseline-scoren. Wilson Therapeutics aktien er steget med hele 24% og er nu i et plus på 125% siden årsskiftet.
Zealand Pharma har påbegyndt et fase I dose-finding studie med long-acting GLP-2 analogen Glepaglutide. Studiet er iværksat efter at fase II data viste, at Glepaglutide har en længere halveringstid end forventet i Short Bowel Syndrom (SBS) patienter, hvilket potentielt muliggør ugentlige behandlinger frem for daglige behandlinger. I dette fase I studie testes forskellige doser og intervaller af Glepaglutide i 75 raske frivillige. På nuværende tidspunkt er 30 forsøgspersoner allerede behandlet. Der ventes resultater fra studiet i 1.kvartal 2018. FDA har desuden givet Zealand Pharma Orphan Drug Designation for Glepaglutide i behandlingen af SBS. Dette vil potentielt give Zealand Pharma en hurtigere behandling hos FDA i forbindelse med fastlæggelsen af det kliniske design af fase III studiet, samt give mulighed for at få refunderet en række udgifter i forbindelse med en eventuel senere registreringsproces. Zealand Pharma forventer fortsat at indlede fase III afprøvning med Glepaglutide i løbet af 2018. Zealand Pharma aktien er dog faldet med 2% og er nu i +11% siden nytår.
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her