Calliditas har hentet ca. 0,7 mia. SEK i netto-provenu i sin IPO hen over sommeren. Selskabet har et særdeles lovende middel mod en alvorlig nyresygdom i fase III studier, hvorfra der kan forventes resultater om ca. 2 år.
Calliditas Therapeutics er et svensk biotekselskab oprindeligt stiftet i 2004 under navnet Pharmalink AB. I 2017 skiftedes man navn til Calliditas Therapeutics. Selskabet har base i Stockholm, Sverige og arbejder på at udvikle medicin målrettet mindre nichesygdomme – de såkaldte orphan drugs – hvor der i dag eksisterer et behov for nye og mere effektive behandlingsmetoder.
Ekstremt stærke fase IIb data
Det altoverskyggende aktiv i pipelinen er medikamentet Nefecon, som er på vej i afsluttende fase III studier i den inflammatoriske nyresygdom IgA nephropathy (IgAN), også kendt under navnet Bergers sygdom.
Nefecon er en oral patenteret udgave af det velkendte steroide/binyrebarkhormon-præparat budesonide. Nefecon er dog udviklet via Calliditas TARGIT-teknologiplatform, hvilket betyder, at det først frigives i nederste del af tyndtarmen, hvor betændelsestilstande opstår. Den meget lokalt virkende formulering betyder også at meget høje doser kan anvendes da omkring 90% er inaktiveret i leveren før det når ud i blodkredsløbet.
Calliditas vurderer, at Nefecon via sin udløsning i nederste del af tyndtarmen også kan have effekt i den kroniske leversygdom autoimmun hepaptis og primær biliær cirrose, som er en betændelsestilstand i galdevejene. Der er dog endnu ikke taget beslutning om at udvikle Nefecon i disse indikationer.
Bergers sygdom er den mest almindelige form for nyrebetændelse (Glomerulonephritis), hvor der over tid opbygges en tiltagende betændelsestilstand i nyrernes mange små filtre. Det betyder, at sygdommen over en periode på 10-20 år gradvist forværres, hvorved selve nyrefunktionen forringes. I nyresygdommes sene stadier – kendt som ESRD (End-Stage Renal Disease) – forsvinder nyrernes mulighed for at skille sig af med affaldsstoffer, hvilket er dødeligt, såfremt det ikke behandles. Omkring 2 mio. mennesker på verdensplan, og 0,7 mio. mennesker alene i USA, har ESRD. Den største undergruppe inden for ESRD er Bergers sygdom. Det estimeres, at samlet set ca. 400.000 mennesker i Europa og USA er ramt af Bergers sygdom og der eksisterer i dag ingen godkendt medicin. Standardbehandlingen består derfor af ikke-effektiv medicin såsom blodtryksænkende midler og ikke specifik steroide-behandling. Op mod 50% af patienterne med Bergers sygdom vil udvikle så fremskreden nyrebetændelse, at kronisk dialyse-behandlingen eller nyretransplantation er eneste mulighed for overlevelse.
Et interessant og perspektivrigt aspekt ved Bergers sygdom er dog, at sygdommen faktisk ikke opstår i selve nyrerne, men derimod i selve tarmsystemet, nærmere bestemt i den nederste del af tyndtarmen. IgA-antistoffer er en del af immunforsvaret og beskytter i raske mennesker mod fremmedlegemer i form virus og bakterierne. Men i patienter med Bergers sygdom er der for mange IgA-antistoffer til stede i den nederste del af tyndtarmen, hvilket fører til at IgA-antistoffer strømmer ud i blodet og angriber andre antistoffer, hvorved betændelsestilstande opstår i nyrernes filtrerings-system. De første tegn på nyresygdom er udskillelse af blod, affaldsstoffer og protein i urinen. Proteinet der udskilles, kendes under navnet proteinuri, og er derfor en præcis biomarkør for, hvor fremskreden en patients nyresygdom er. En biomarkør for affaldsstofferne der udskilles er kreatinin, og er i dag den foretrukne biomarkør for nyresygdom og anvendes til beregning af nyrefunktion via eGFR (Estimeret glomerulær filtrationshastighed).
I november 2017 kunne Calliditas oplyse, at FDA har godkendt, at proteinuri kan anvendes som det primære målepunkt i det forestående fase III studie med Nefecon i Bergers sygdom. Dette er særligt opmuntrende efter at resultater fra et stort placebo-kontrolleret fase 2b studie med i alt 150 patienter viste, at Nefecon efter 9 måneders daglig behandling reducerede udskillelsen af proteinuri med 27,3% og 21,5% på hhv. 16 mg og 8 mg Nefecon. Til sammenligning sås en stigning i proteinuri på 2,7% i placebo-armen.
Desuden forringedes nyrefunktionen målt via eGFR med 9,8% i placebo-armen, mens nyrefunktionen viste stort set uændrede værdier for både 8 mg og 16 mg Nefecon (-0,9% og +0,6%).
Nefecons sikkerhedsprofil var samtidig ganske solid og der observeredes ingen metaboliske eller kardiovaskulære forskelle mellem placebo og Nefecon. De kliniske resultater indikerer samtidig, at Nefecon kan reducere udskillelse af protein, samt fastholde nyrefunktionen og muligvis langsomt forbedre den over tid. Kan disse resultater gentages i fase III, vil det med stor sikkerhed betyde, at Nefecon vil indtræde som ny primær standardbehandling på et meget stort marked og formentlig i en række tilfælde erstatte dialyse-behandling.
I august 2018 har Calliditas påbegyndt fase III studiet med Nefecon. Forsøgsdesignet er det samme som i fase IIb dog med den forskel, at man kun anvender Nefecon på 16 mg dagligt dosisniveaue og holdt op imod placebo. I alt vil man optage 450 patienter, men studiet er opdelt i fase IIIa og fase IIIb således, at man allerede efter 9 måneder behandling af de første 200 patienter vil afrapportere data (fase IIIa) for det primære endpoint proteinuri. Vigtigt er det også at Calliditas har indgået aftale med FDA og EMA om man kan få Nefecon godkendt baseret på disse data såfremt primary endpoint er opfyldt naturligvis.
Fase III studiet vil optage totalt set 450 patienter, og man vil herefter i fase IIIb forsøge at påvise, at Nefecon også over tid kan fastholde nyrefunktionen målt via eGFR bedre end placebo-behandling. Dette er dog et event-drevet endpoint, som tager længere tid, da patienterne først skal have oplevet et relevant tab af nyrefunktion, før det tæller som et event. Et bud kunne være, at et nyrefunktionstab på 20% i eGFR tæller som et event, hvilket typisk vil tage 2 år (for patienter på placebo-behandling) og forhåbentligt meget længere tid i gennemsnit for patienter i Nefecon-armen. Der er indlagt delvejsanalyser undervejs således, at studiet kan afbrydes, såfremt Nefecon viser statistisk signifikant bedre eGFR-effekt efter et på forhånd fastsat antal events.
IPO indbringer ca. 700 mio. SEK
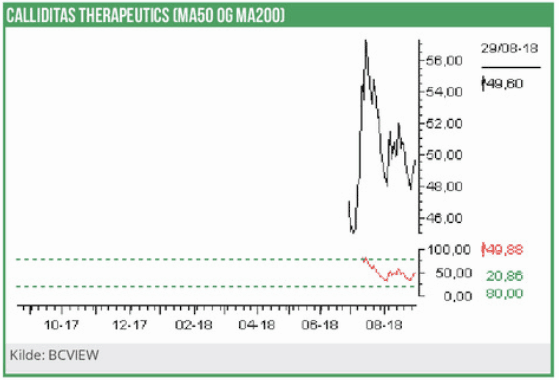
Caliditas blev optaget til handel på Nasdaq OMX Stockholm med første handelsdag d. 29.juni 2018. I perioden 17.-28. juni gennemførtes en IPO-emission, hvor alt 14,44 mio. nye aktier blev udbudt til en tegningskurs på 45 SEK. Emissionen blev fuldtegnet, hvorved Calliditas har rejst et provenu før omkostninger på 650 mio. SEK. Blandt investorerne er AFA Insurance, Gladiator, Handels-banken Fonder AB og Svenske National Pension Fonden (AP4).
Desuden udbudtes ca. 2,17 mio. aktier i overallokeringsret til emissionenbanken Carnegie. Heraf blev de 1,97 mio. aktier udnyttet, hvilket har øget emissionens samlede provenu med ca. 89 mio. SEK. Calliditas har desuden valgt at konvertere et eksisterende lån på 95,2 mio. SEK til 2,11 mio. nyudstedte aktier, ligeledes til en tegningskurs på 45 SEK.
Dermed stiger det samlede antal udestående aktier i selskabet med ca. 18,46 mio. aktier, således, at aktiekapitalen nu består af 35,20 mio. aktier.
Calliditas vil anvende nettoprovenuet fra emissionen (formentlig omkring 700 mio. SEK), på at gennemføre fase III forsøget i Bergers sygdom. Calliditas forventer at have resultater fra studiets fase IIIa, således at man vil kunne indsende en registreringsansøgning i USA og Europa i l. halvår 2021. Calliditas regnskab for 1.halvår 2018 blev fremlagt d. 16. august og viste ganske som ventet et voksende underskud. Udgifterne til R&D er således steget med 186% til nu ca. 50 mio. SEK. Dette betyder, at underskuddet efter skat er fordoblet til nu -56 mio. SEK.
Ved udgangen af juni er det likvide beredskab opgjort til 17 mio. SEK, og omfatter således endnu ikke nettoprovenuet fra IPO’en på ca. 700 mio. SEK.
85% chance for positive fase III data
Vi forventer at Calliditas med det nuværende meget solide kapitalberedskab, vil have tilstrækkelig kapital til og med hele 2019. Vi forventer fase IIIa resultater fra Nefecon-studiet sent i 2.halvår 2020. Dette betyder at selskabet efter alt at dømme skal ud at rejse yderligere kapital før data foreligger, med mindre man indgår en partneraftale på Nefecon. Vi ser det på ingen måde som problematisk at skulle rejse yderligere kapital i 2019, hvis det er den løsning man vælger, da man på dette tidspunkt vil stå med en stærk case og med ganske kort tid til afrapportering af resultater.
Vores vurdering er at fase IIb resultaterne med Defecon er ekstremt stærke og meget statistisk solide. Vi vurderer det endvidere som stærkt positivt, at Calliditas har fået tilladelse af FDA til at anvende proteinuri som det primære endpoint, fremfor som normalt eGFR, som pt. er et mere anerkendt mål for nyrefunktion. Det betyder også at resultater fra den registrerings-berettigende fase IIIa vil kunne komme allerede om ca. 2 år.
Vi sætter sandsynligheden for positive resultater i fase IIIa til omkring 85%, og sandsynligheden for positive resultater i fase IIIb til 75%. Vi ser et peaksale potentiale for Defecon på minimum 1 mia.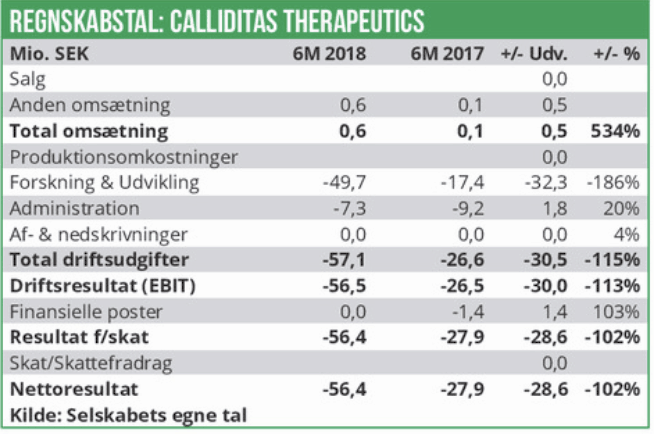
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her











