Som bekendt afholdt ØU Life Science for nylig en investorkonference, hvor AcouSort, Hamlet Bioharma, Fluoguide, BioArctic, Camurus og Curasight præsenterede og besvarede spørgsmål. Samtlige præsentationer kan ses her på dette link, men vi har også samlet et lille todelt referat, hvor vi i dag ser på hvad BioArctic, Camurus og Curasight præsenterede. I næste udgave følger referat af de sidste 3 selskabers præsentationer.
Curasight
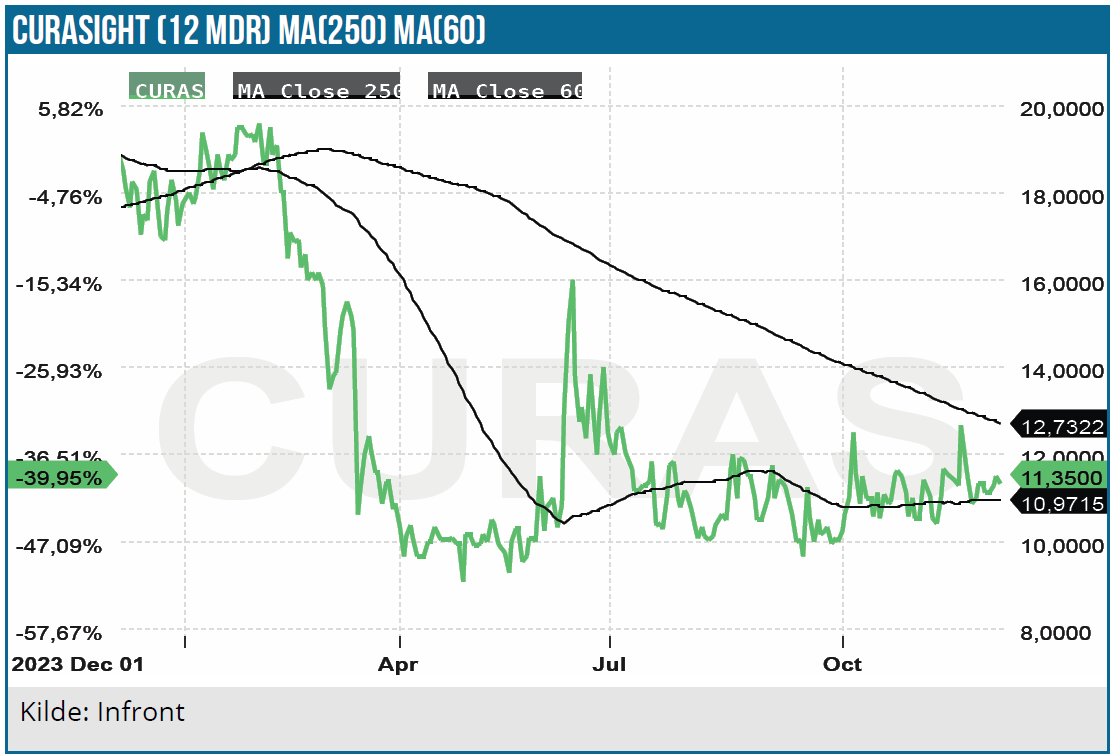
For Curasight præsenterede CEO Ulrich Krasilnikoff. Selskabet beskæftiger sig indenfor nuklear-medicin og -diagnostik, som er et område, der har ligget og ulmet de sidste par år, efter at Novartis satsede et stort milliardbeløb i opkøb i årene før pandemien. Med nylige store opkøb i 2023 fra bl.a. Bristol-Myers og Eli Lilly er området igen ved at komme i fokus. Bristol-Myers købte Rayze Bio for 4,2 mia. USD, mens Eli Lilly købte Point Biopharma.
Curasight er aktuelt i gang med tegningsperioden for de udstedte tegningsoptioner TO2, som med en tegningskurs på 11,50 DKK per aktie kan give op til 42 mio. DKK i kassen til at finansiere videreudviklingen af selskabets 2-delte pipeline-platform.
Selskabet arbejder med en todelt pipeline, idet man både arbejder ”diagnostisk” og ”terapeutisk”. Den diagnostiske del hedder uTRACE, mens den terapeutiske del hedder uTREAT. Det er klart, at det største kommercielle potentiale ligger i uTREAT, hvor man potentielt kan strålebehandle cancercellerne helt lokalt i kroppen via injektioner fremfor via strålekanoner, der også rammer rask væv. Helt enkelt sagt finder uTRACE frem til kræftcellerne med uPAR og binder derefter til dem og udløser en medfølgende kortrækkende stråling. UTRACE finder kræftceller via uPAR og lyser dem derefter op ved normale PET-scanninger.
Indenfor uTRACE er Curasight kommet godt i gang på partnerfronten, hvor man i 2023 underskrev en partneraftale med det globale selskab Curium indenfor prostatakræft. Her er der igangsat et fase 2 studie, hvor de præliminære efficacy data kan forventes inden udgangen af året. Curium-partnerskabet sigter efter at nå fase 3 data i 2026 og nå en markedsføringsgodkendelse i 2027. Curasight har også for nylig underskrevet en ”produktions-/leveringsaftale” med Curium, således at man har sikret sig produktion af de radioisotoper, der indgår i uTREAT.
Indenfor uTREAT er der nu udsigt til, at den helt store value-driver bliver bragt i spil, når Curasight forventeligt i 2. kvartal 2025 opstarter et fase 1/2a studie i hjernekræft, som vil kunne levere de første data inden udgangen af 2025.
Der er mange indikationer at udvikle indenfor både uTREAT og uTRACE, og derfor er det afgørende, at selskabet får flere partnerskaber i hus, som kan validere teknologien og selskabet, finansiere udviklingen og hjælpe med at få pipelinen hurtigere frem til godkendelse til gavn for patienterne. Der er samtaler med mulige partnere, men indenfor uTREAT skal der formentlig fase 2 data på bordet, førend interessen bliver rigtig stor og udmønter sig i aftaler.
Se hele Curasights præsentation her
BioArctic
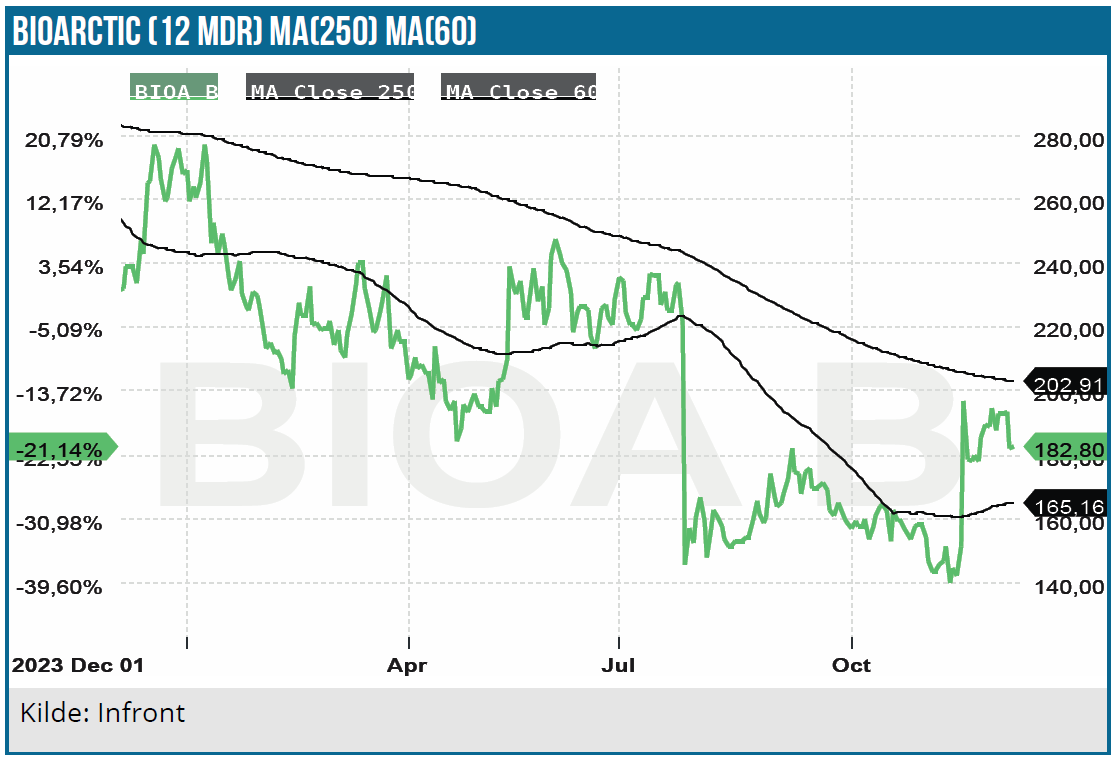
For BioArctic præsenterede Head of IR Oscar Boasson. Trods lidt små startvanskeligheder på den kommercielle side ser der fortsat ud til at være store perspektiver i BioArctics Alzheimer-middel Leqembi, som partneren Eisai udvikler, markedsfører og sælger. Leqembi er globalt set det første fuldt godkendte lægemiddel til behandling af alzheimers og er oprindeligt udviklet af BioArctic. Det er ikke en kur mod alzheimers, men et middel til at stoppe eller sænke hastigheden i sygdommens progression.
Det nylige tilbageslag i Europa, hvor EMA’s rådgivende komité i første omgang afviste at anbefale en godkendelse, er nu annulleret idet en gen-eksamination af ansøgningen har ført til en positiv anbefaling, der indenfor 67 dage formentlig vil lede til en formel markedsføringsgodkendelse fra EU-kommissionen. Herefter er vejen banet for en udrulning i Europa, hvor BioArctic i Norden forventer selv at spille en rolle også som følge af den co-promotion aftale, der ligger i samarbejdet med Eisai. En godkendelse i EU vil udløse en milepælsbetaling fra Eisai – antageligt imellem de 17 mio. EUR, som blev udløst ved godkendelsen i Japan, og de 25 mio. EUR, som blev udløst ved godkendelsen i USA.
Den lidt sløve salgsstart, som bl.a. skyldtes mangel på infusionsstole, har dog ikke rykket ved det enorme markedspotentiale, hvor Eisai så sent som i oktober har talt om et salg på 8,8 mia. USD i 2032, vel at mærke ved en relativt beskeden markedsandel. Med 9 % royalty til BioArctic er der udsigt til en solid og stigende indtægtsstrøm i de kommende år, hvor især nye udgaver af Leqembi skal støtte op om salgsvæksten.
I første omgang er der tale om en subkutan version til maintenance behandling og sidenhen en subkutan version til den initiale behandling. Det er BioArctics forventning, at salget først vil tage fart, når de subkutane versioner kommer på markedet i løbet af 2025 (for maintenance) og måske allerede 1. kvartal 2026 (for initial behandling).
Eisai har netop rekrutteret den sidste patient til et 4-årigt studie i tidlig alzheimers (pre-symptomatic) for at se, hvor stor en effekt man kan få af at starte behandling endnu tidligere end i dag.
Eli Lilly er nu også ved at melde sig på markedet med deres lægemiddel, som umiddelbart har en bedre virkning. Administrationen er anderledes, idet Lillys produkt er en gang månedligt, mens BioArtics gives hver anden uge, indtil den subkutane version kommer på markedet.
BioArctic præsenterede også sin teknologi ”BrainTransporter™”, som ser lovende ud ift. at gennemtrænge blod-hjerne barrieren og åbner dermed op for behandling af flere neurologiske sygdomme. Længst fremme er man med Parkinson-indikationen, hvor et fase 2a studie er tæt på at starte.
Se hele BioArctics præsentation her
OBS! Efter præsentationen har BioArctic meldt om regulatoriske godkendelser i Mexico og Sydkorea samt opstart af fase 2a studiet i Parkinsons.
Camurus
For Camurus præsenterede Chief Business Development Officer, Fredrik Joabsson. Bortset fra den nylige afvisning i USA (pga. inspektionsproblemer hos kontraktproducenten) ser det uændret lyst ud for Camurus, som også leverer varen til fulde i form af solid vækst i antallet af behandlede patienter.
Selskabet bygger sin pipeline af lægemiddelprojekter på sin unique fluid crystal technology, som giver mulighed for, at et lægemiddel skal gives sjældnere end normalt, samtidig med at optagelsen i kroppen kan forbedres.
Det er særligt praktisk, når det kommer til det førende lægemiddel, buvidal mod opiodafhængighed. Her gør det en stor forskel i udfaldet af behandlingen, hvis patienten kan nøjes med én langtidsvirkende injektion på månedsbasis fremfor f.eks. en gang daglig. Eksempelvis er der kun 25-30 % i fortsat behandling efter 1 års daglig behandling med standardlægemidlet, mens Camurus oplever, at 80-90 % fortsat er i behandling efter 1 år med langtidsvirkende buvidal.
Selskabet har 250 ansatte, hvoraf de 150 sidder på hovedkontoret i Lund, mens resten primært er i den kommercielle organisation i Europa, USA og Australien. Selskabet er lidt endnu (pga. afvisningen i USA) et one-product company, men et meget succesfuldt et af slagsen. Camurus’ medicin behandler i dag 56.000 patienter i Europa og Australien, og målsætningen er 100.000 i 2027. Hidtil har Camurus leveret en flot og kontinuerlig vækst i antallet af behandlede patienter. I sidste kvartal solgte man f.eks. flere enheder end den tidligere markedsleder (sublocade). Partneren i USA er også kommet godt i gang med salget, og her er der et markedspotentiale på over 1 mia. USD.
I den nære fremtid er det godkendelsen og kommercialiseringen af de kommende indikationer i USA indenfor acromegali og NET, hvor to af konkurrenterne er Novartis og Ipsen, som begge også har langtidsvirkende lægemidler. Markedet er på ca. 3 mia. USD, men problemet er, at kun ca. halvdelen af patienterne ser ud til at respondere. Camurus siger selv, at deres lægemiddel kan levere 5x bioavailability, og det kan være vejen til at se en højere respons/effektivitet i behandlingen. Sammen med en række andre faktorer kan det være afgørende for et godt salg, hvis CAM2029 opnår godkendelse i alle indikationerne. I så fald er der tale om peaksale estimater i niveauet 1,5-2 mia. USD, hvor NET (neuroendocrine tumors) klart repræsenterer det største potentiale på op mod 1,5 mia. USD.
Et sidste og interessant emne i præsentationen var oplysningen om, at man er i gang med udviklingen af en langtidsvirkende version af Novos semaglutide. Camurus var lidt sparsom med oplysningerne, men det kom dog frem, at versionen kan være klar til godkendelse omkring 2030, hvilket ikke overraskende falder sammen med patentudløbet på Wegovy/semaglutide. De første data fra semaglutide-studiet ventes i slutningen af 2025.
Selskabet har en solid kassebeholdning og også en udmeldt strategi om in-organic growth. Her er det ikke utænkeligt, at Camurus finder på opkøb af projekter eller lægemidler i umiddelbar tilknytning til det eksisterende CAM2029 franchise (”something around CAM2029 franchise” blev der konkret sagt). Hovedidéen er formentlig at styrke og udnytte den kommercielle organisation endnu bedre.
Se hele Camurus præsentation her
Links til slides og næste konference
Alle præsentationer og slides fra den seneste konference kan genses her – også fra de 3 selskaber (Fluoguide, AcouSort og Hamlet Biopharma), som der ikke er referat på i dag.
Næste konference løber af stablen den 19. februar 2025. Læs mere på vores nye konferenceside, som kan tilgås via topmenuen på ugebrev.dk eller direkte via dette link. Her kan man se mere information om kommende konference og finde præsentationer og slides fra tidligere konferencer.
Camurus ligger også i ØU Life Science Modelporteføljen.
Steen Albrechtsen