Egetis’ førende lægemiddelkandidat Emcitate retter sig mod MCT8-mangel, en sjælden genetisk sygdom karakteriseret ved mangel på thyroideahormon (T3) i hjernen, hvilket resulterer i nedsat hjerneudvikling og motorisk svækkelse fra en meget tidlig alder. Positive kliniske forsøg med Emcitate og udsigten til snarlig myndighedsgodkendelse i EU og USA betyder, at aktien i den nuværende situation anses for at være attraktiv.
Undersøgelser har vist, at pædiatriske og voksne patienter behandlet med Emcitate (Tiratricol) for MCT8-mangel har en tre gange lavere risiko for dødelighed end patienter, der ikke er behandlet med produktet. I midten af juli meddelte Egetis, at ETA (European Thyroid Association) anbefaler Emcitate som en langtidsbehandling for MCT8-mangel for alle patienter med sygdommen og også for nogle patienter med RTH-beta i nye 2024-retningslinjer.
Selskabet oplyste i sin halvårsrapport, at i ReTRI-ACt-studiet, som er beslutningsgrundlaget for markedsgodkendelse i USA, har 6 patienter gennemført studiet, og Egetis forventer, at yderligere 2 vil blive randomiseret, og at yderligere 6 patienter vil begynde screeningen. For at øge rekrutteringsraten i studiet, som er randomiseret og placebokontrolleret, åbner Egetis yderligere tre studiecentre i USA. Studiet afsluttes, når der er data fra i alt 16 patienter.
Data forventes i 1. halvår 2025, hvilket kan betyde en godkendelse i slutningen af 2025 og sandsynligvis et muligt salg af PRV (voucher) i begyndelsen af 2026, som kan give et vigtigt kapitalboost til kommercialiseringen i USA.
Ift. Europa meddelte Egetis i august, at de havde svaret på EMA’s 120-dages liste med spørgsmål, som er en del af EMA’s ansøgningsgennemgang. Næste trin i processen er en 180-dages liste med de sidste eventuelle spørgsmål.
Egetis markedsfører endnu ingen produkter, men selskabet realiserer dog allerede omsætning fra ”early access”. Selskabet retter sig mod attraktive sjældne sygdomme, hvor man generelt ser en overgennemsnitlig sandsynlighed for regulatorisk godkendelse, høje priser og ingen konkurrence fra godkendte behandlinger.
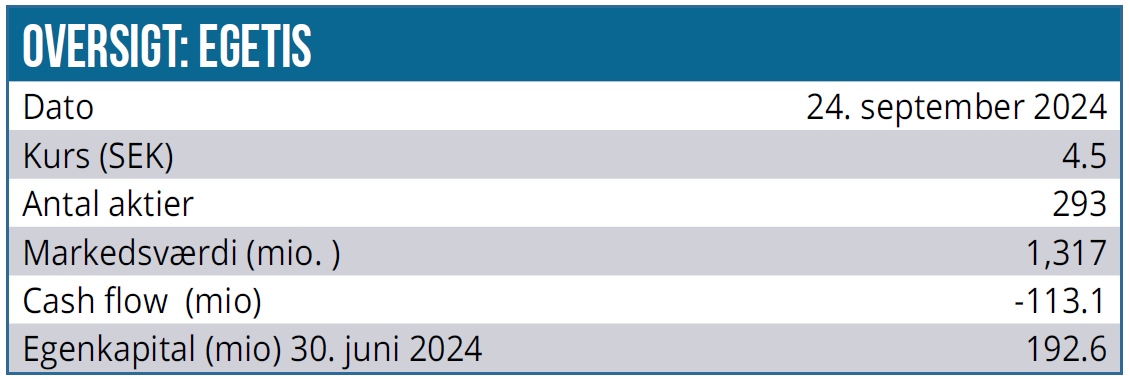
I 1. halvår af 2024 udgjorde Egetis’ omsætning 25,9 mio. SEK sammenlignet med 12,7 mio. SEK året før. Periodens tab faldt fra 154,4 mio. SEK i 2023 til 146,9 mio. SEK. Likvider udgjorde ved udgangen af 2. kvartal 192,6 mio. SEK, og pengestrømme udgjorde -113,1 mio. SEK.
Det kræver ikke store regnekundskaber at se, at Egetis formentlig snart vil have behov for en kapitaltilførsel. Den oplagte timing synes at være i kølvandet på den forventede positive indstilling fra EMA som forventes i starten af det nye år. Vi antager et behov for kapitaltilførsel på ca. 120 mio. SEK. Selskabet har en lånemulighed, som er bundet op på udviklingen i selskabets lille amerikanske studie (formentlig afslutning af studiet), men den konkrete timing er ikke præciseret, og det vil formentlig være lidt for tæt på afgrunden, hvis man venter så længe.
Blandede TRIAC II data
I juni annoncerede Egetis toplinjeresultater fra dets supplerende (men ikke-registreringsbærende) TRIAC II studie med fokus på neurokognition hos MCT8-patienter yngre end 30 måneder. Studiet indfriede ikke sine primære endpoints, da de observerede numeriske forbedringer fra baseline ikke viste statistisk signifikans, men altså dog en numerisk forbedring. En fuldstændig evaluering af dette vil sandsynligvis blive vist i en fremtidig præsentation af studiet på en videnskabelig konference.
Studiet bekræftede dog derudover den “signifikante og vedvarende reduktion i endogene T3-koncentrationer hos alle patienter og den veltolererede sikkerhedsprofil for Emcitate set i tidligere kliniske undersøgelser på trods af den højere dosis per kg kropsvægt og lang behandlingsvarighed (2 år)”. Mindre væsentligt er det, at studiet vil dermed bidrage til at styrke sikkerheds- og tolerabilitetsdataene for Emcitate.
Vi forventer ikke, at resultaterne fra studiet vil påvirke sandsynligheden for myndighedsgodkendelser væsentligt, da virksomheden allerede har aftalt med FDA og EMA, at ansøgningen vil være baseret på eksisterende/replikerede data.
Vi forventer heller ikke en særlig stor indflydelse på prisen – især i USA, hvor andre mere standardiserede faktorer ser ud til at påvirke prisen mere. Vi mener dog, at det sundhedsøkonomiske rationale, især at diagnosticere/screene patienter meget tidligt, ville være højere, hvis forsøget havde været vellykket. Prisfastsættelsen i EU vil dog sandsynligvis i mindre omfang blive negativt påvirket.
Early access program styrker kommerciel start
Da sygdommen er sjælden, og bevidstheden, selv blandt speciallæger, er lav, har Egetis indtil videre i 2024 deltaget i mere end 17 videnskabelige konferencer med relevans for MCT8-mangel for at forbedre kendskabet til sygdommen og dens diagnose. Forbedret diagnostik og bevidsthed om sygdommen er nøgleudfordringer i kommercialiseringen af Emcitate.
Der er stor interesse fra læger verden over for at behandle patienter med MCT8-mangel med Emcitate, og det må fremhæves, at man allerede har ca. 220 patienter indrulleret i 25 lande i early access programmer, og det giver begrundet håb om en god kommerciel start, når/hvis Emcitate bliver godkendt.
Efter anmodning fra FDA har Egetis også opstartet et early access program i USA. Der er nu 8 centre i USA, der kan dosere patienter i EAP, og 10 flere er i gang med at indrullere sig i programmerne, som grundlæggende gør det lettere for læger at få adgang til lægemidlet til de patienter, der ikke deltager i kliniske forsøg. Programmet giver dermed også fortsat adgang til Emcitate de patienter, der allerede har gennemført ReTRIACt-studiet.
Fremtidsudsigterne
Egetis har nu modtaget Promising Innovative Medicine-betegnelsen i Storbritannien (PIM) fra den britiske sundhedsmyndighed MHRA, som fastslog, at Emcitate kan klassificeres som en lovende behandling for patienter med MCT8-mangel.
For 2024 har Egetis fire hovedprioriteter:
- Fuldføre det registreringsbaserede ReTRI-ACt-studie i USA så hurtigt som muligt.
- Få en positiv udtalelse fra EMA for Emcitate til behandling af MCT8-mangel
- Pre-lancering aktiviteter i Europa
- Forberedelser til ansøgning om markedsgodkendelse for Emcitate i USA Emcitate planlægges lanceret på egen hånd via en fokuseret, intern kommerciel organisation, hjulpet af stærk KOL-støtte. En amerikansk godkendelse vil udløse en “priority review voucher” (PRV) med en salgsværdi på ca. 100 mio. USD. Provenuet skal dog deles med de oprindelige ejere af Emcitate.
Der er klare udfordringer, som Egetis skal forholde sig til for at opnå kommerciel succes. Udover opbygning af en lille men kompetent kommerciel organisation, er en stor barriere, at sygdommen MTC8-mangel stadig er underdiagnosticeret, og der er risiko for, at antallet af diagnoser hos spædbørn forbliver lavt, indtil en bredere screening vedtages.
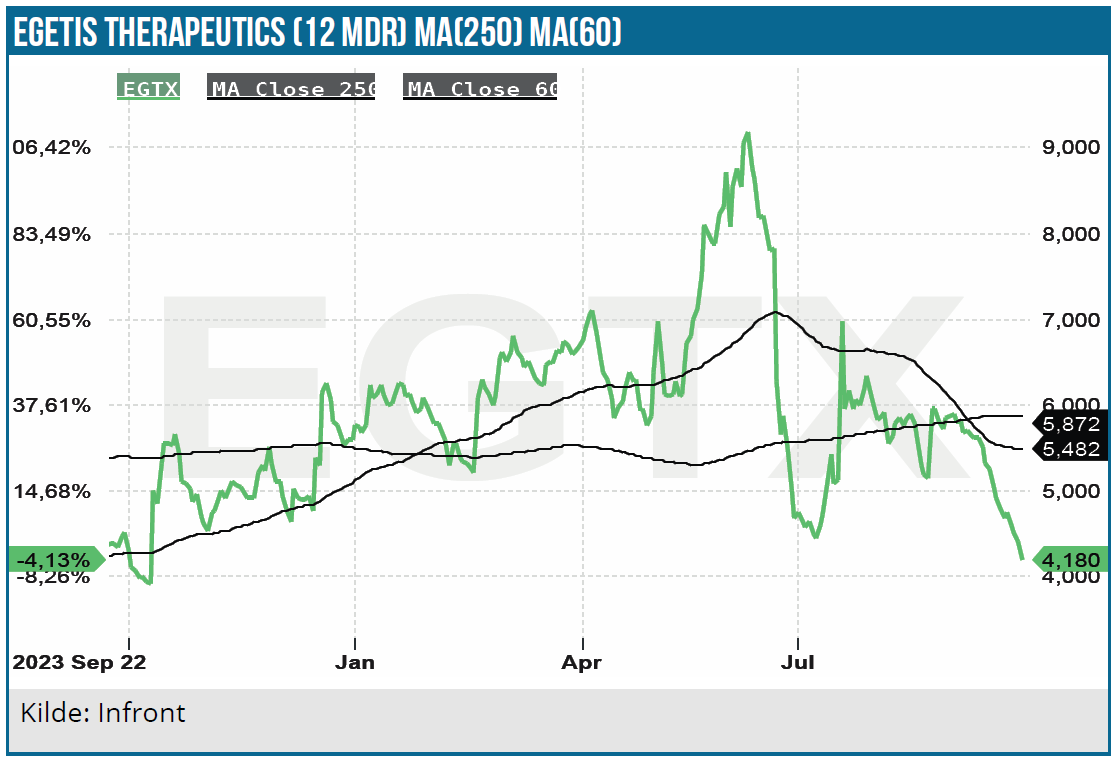
På trods af nogle udfordringer ser vi den seneste udvikling som meget positiv, og der synes at være en betydelig upside for Egetis’ aktie i takt med fremskridtene for Emcitate.
Vi ser en høj sandsynlighed for godkendelse i EU, USA og i Japan. Efter vores vurdering er investeringscasen for Egetis overbevisende, og vi forventer, at interessen for aktien vil stige jo tættere vi kommer på kommercialiseringen. Risikoen for, at der skal hentes kapital en gang mere førend cash break-even nås, er som nævnt til stede, og det lægger muligvis en dæmper på kurspotentialet på helt kort sigt.
Aktien synes også at være spekulativ, og det er måske ikke helt udelukket, at der igen kan opstå salgs- eller M&A-rygter, jo tættere vi kommer på regulatorisk godkendelse.
Vi kigger nu efter et kursmål på 13 SEK med en tidshorisont på 12-24 måneder.
Kurs på anbefalingstidspunkt: 4,4 SEK
Kursmål: 13 SEK
Analysedato: 24. september 2024 Disclaimer: Læs her om ØU’s aktieanalyser.
Andrea Backlund
Disclaimer: Læs her om ØU’s aktieanalyser.

Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her