Det har været småt med nyheder fra Infant Bacterial Therapeutics siden de skuffende fase 3 data i september, men det blev der lavet om på i denne uge, hvor man annoncerede at have modtaget BTD på IBP-9414. Alt andet lige bør det gøre vejen til godkendelse lidt nemmere, og dermed kommer det mulige blockbusterpotentiale også lidt tættere på. Kursen afspejler lige nu ikke dette potentiale, hvilket naturligvis er en konsekvens af usikkerheden, om de præsenterede fase 3 data er nok til godkendelse. Der er stort potentiale i aktiekursen, men det er i bund og grund stadig binært.
Infant Bacterial Therapeutics er ikke et selskab, der overstrømmer investorerne med information, ligesom man også ofte er relativt afmålt i sin kommunikation, når man endelig siger noget. Det sidste har vi set flere eksempler på efter fase 3 studiet ”The connection study”, der som bekendt ikke nåede helt i mål på de primære endpoints, men blandt de vigtige sekundære endpoints var der en signifikant forbedring i overlevelsen (reelt set sås en lavere ”all-cause mortality”) hos de for tidligt fødte babyer, og det er jo i sig selv det vigtigste målepunkt hos både læger og forældre.
Man skal ikke have læst mange børsmeddelelser fra biotekselskaber, førend man hurtigt kan lave en regel om, at der skal være flotte optimistiske ord i, førend man kan antage, at det vitterlig er positive nyheder. Næsten klassisk er en udtalelse om, at man er opmuntret (”encouraged”) af f.eks. de fremlagte data, hvorefter man kan se aktiekursen falde med 50 %. Vi kan ikke her føre videnskabeligt belæg for denne antagelse, men vil dog gerne slå fast, at der en tendens til, at biotekselskabers optimistiske udmeldinger i deres pressemeddelelser ofte står i skærende kontrast til, hvordan kursen (og dermed investorerne) reagerer på selvsamme nyhed.
IBT er måske her undtagelsen, for statusopdateringen lige før jul emmer ikke af jubeloptimisme. Efter at have kigget nærmere på fase 3 data og diskuteret dem med FDA blev det bl.a. til en ret enkel konstatering af, at man ikke ser nogen grund til at stoppe udviklingen af IBP-9414: ”IBT has also met with the FDA during this quarter. After the continued review and dialog with the FDA, IBT sees no reasons to discontinue the drug development of IBP-9414 as previously decided”.
Og så var der ikke meget mere at komme efter i den meddelelse.
I denne uge har IBT meddelt, at man har modtaget Breakthrough Therapy Designation (BTD) fra FDA, hvilket giver medvind i ansøgningsprocessen og også indikerer, at FDA ser positivt på IBP-9414. Især også fordi BTD-designationen er givet så sent i forløbet, hvor fase 3 studiet er gennemført, og der er fulde kliniske fase 3 data at kigge på.
FDA’s BTD-program har vi behandlet flere gange i ØU Life Science, ikke mindst i forbindelse med Genmab, som har fået flere BTD’ere i sin levetid. Mest interessant er naturligvis, at megablockbusteren Daratumumab fik BTD som et af de allerførste lægemidler efter ordningens indførelse. Sidenhen har vi også set Bavarian Nordic få det til sit RSV-vaccineprojekt (før fase 3 data forelå), hvilket tjener som eksempel på, at BTD ikke er en 100 % garanti for godkendelse eller klinisk succes.
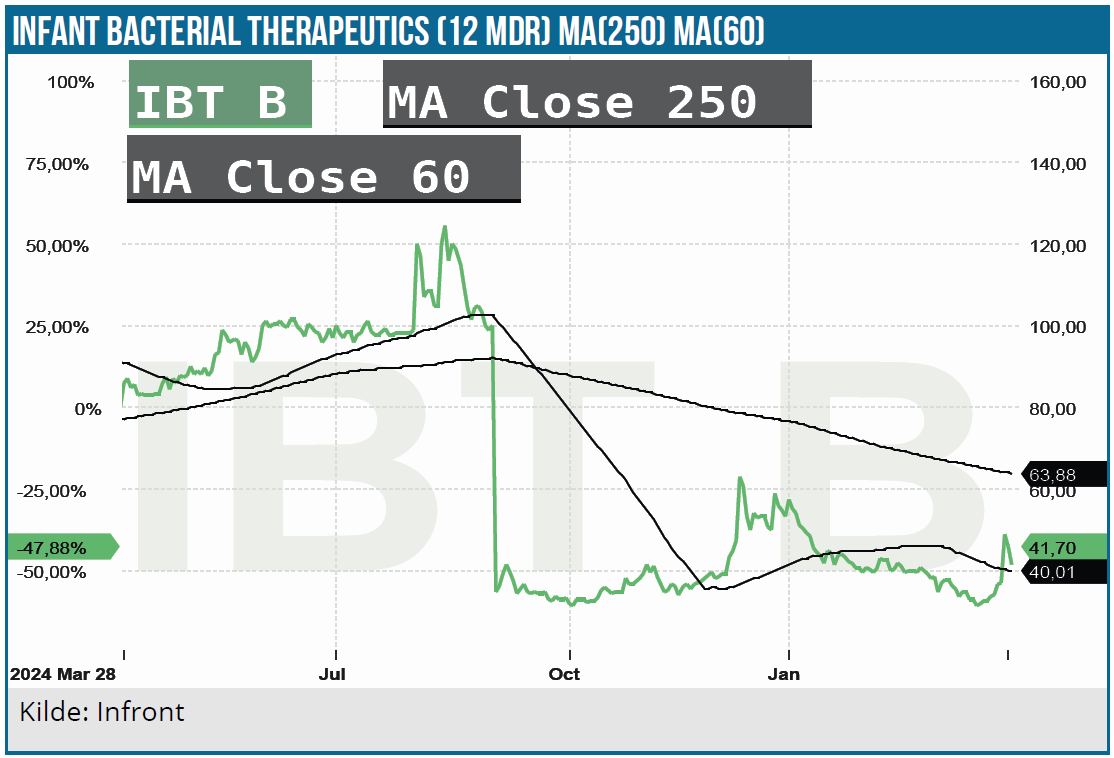
Det var dog bemærkelsesværdigt ovenpå BTD-tildelingen i denne uge at se den kraftige kursreaktion i IBT-aktien, der en overgang steg med over 50 %. Selvom stigningen fadede noget ud senere på dagen – også på grund af de sure markeder generelt – indikerer den, at der blandt investorerne ikke var voldsom stor tiltro til, at IBP-9414 bliver godkendt.
En BTD giver ekstra involvering fra FDA i processen, og selvom den primære del af den kliniske udvikling er overstået, bør BTD være en hjælpende hånd, der kan være med til at sikre en hurtigere proces med feedback, som kan hjælpe med at undgå fejl og sænke risikoen for at noget i ansøgningen ikke er som tiltænkt.
CEO Staffan Strömberg siger det også rimelig klart i selve meddelelsen (vores understregning): In December 2024, the FDA and IBT agreed that IBT should submit all available clinical data enabling a full review by the FDA of the totality of evidence. IBT is now preparing for the submission in parallel with the activities for the launch of IBP-9414. With the Breakthrough Therapy Designation approved I am very hopeful that full review of the available data leads to an approval. The Breakthrough Therapy Designation from the FDA allows us to collaborate even more closely with the agency to quickly bring IBP-9414 to the market.”, says Staffan Strömberg, CEO of IBT.
Ift. en mere præcis timing har IBT i deres nylige årsrapport skrevet, at man forventer at indlevere ansøgning til FDA i 1. halvår 2025, hvilket også betyder, at en godkendelse kan komme omkring årsskiftet eller i starten af 2026.
Blockbuster er en mulighed
IBT har endnu ikke talt mere præcist om, hvordan de forventer markedet vil udvikle sig, og hvordan markedspotentialet ser ud ovenpå de lidt usikre fase 3 data. Vi har kun estimater fra en tidligere 2022-præsentation om 630 mio. USD-marked i USA (60 % populationsdækning, 5.000 USD/uge, 5,6 ugers behandling), omtrentlig den samme værdi i EU (flere patienter, men lavere pris og kortere behandlingstid) og det halve i resten af verden. Samlet set bliver det til et peak-salgspotentiale omkring 1,5 mia. USD (eller ca. 15 mia. SEK), som vi skal sætte i forhold til en aktuel markedsværdi på 600 mio. SEK ved kurs 44.
Markedspotentialer skal man altid være lidt varsom med at lægge stor vægt på, fordi det kræver ofte en stor og velorkestreret kommerciel indsats at nå dertil. Det er også værd at notere, at IBT selv i regnskabsnoterne anfører at to eksterne healthcare-konsulentfirmaer i 2014, 2016 og 2021 har estimeret markedspotentialet i USA til 200-360 mio. USD, hvilket danner basis for en for en nedskrivningstest af de aktiverede udviklingsomkostninger på kun 8,8 mio. SEK.
Det er klart, at selv betydeligt lavere salgspotentiale end 1,5 mia. USD kan give en glimrende business case for IBT, men det afhænger 100 % af det meget binære udfald for IBP-9414 godkendelsen.
Ultimo 2024 var kassebeholdningen på 223 mio. SEK, og det bør række til ind i 2026. Det er også muligt, at IBT også får en Priority Review Voucher ved den mulige godkendelse. I sig selv er det aktuelt en værdi i nærheden af 150 mio. USD eller 1,5 mia. SEK, som vil være en kærkommen kapitalindsprøjtning til de kommercielle investeringer i lanceringen.
Selskabet er i gang med at udarbejde en strategi for ”distributionspartnere” uden for US, som umiddelbart er det eneste område, hvor man selv vil tage det fulde kommercielle ansvar. Brugen af ordet ”Distributionspartnere” indikerer, at IBT ikke umiddelbart går efter et mere klassisk biotech-partnerskab, hvilket også synes naturligt når udviklingsrisikoen er taget. IBT er også på den front ganske ordknappe så vi må afvente de egentlige aftaler, førend vi bliver klogere på økonomien og ansvaret i dem. Aftalerne og aftalepartnerne vil også i sig selv sige en del om markedspotentialet for IBT-9014.
PRV fortsat i spil
For at få Priority Review Voucher (PRV) skal lægemidlet have RPDD og godkendes inden udgangen af september 2026, hvilket bør være en mulighed, hvis ikke der tilstøder komplikationer i ansøgningsprocessen undervejs. IBT-9414 har modtaget Rare Pediatric Disease Designation (RPDD) allerede i 2016 og dermed i god tid førend 20. december 2024, hvor ordningen formelt set udløb på grund af manglende forlængelse fra kongressen. FDA ser dog ud til at være fortsat med at tildele RPDD’ere, men indtil videre sker det uden mulighed for at tildele disse en PRV også.
Tildelingen af RPDD og PRV er dermed to forskellige processer, og en RPDD er ikke en 100 % garanti for at få udstedt en PRV også i forbindelse med godkendelsen af lægemidlet. Men vi ser det som overvejende sandsynligt.
I seneste omtale ovenpå de første toplinjedata fra studiet i september indtog vi en noget afventende holdning pga. usikkerheden, om de fremlagte data var nok til at sikre godkendelse. Siden da må vi konstatere, den usikkerhed bør være blevet noget mindre, og vi er klar til at genindføre det suspenderede kursmål.
Vi kigger i første omgang efter et kursmål på 75 SEK (markedsværdi 1 mia. SEK), som vi forventer at se inden FDA-godkendelse, men i takt med at investorerne får større tiltro til, at IBP-9414 kan nå markedet. Det er klart, at potentialet er betydeligt højere, hvis IBP-9414 bliver godkendt, og selskabet også selv begynder at tale om PRV’en. I det scenarie taler vi naturligvis om en tilbagevenden til tidligere 3-cifrede kurshøjdepunkter, men det er blot drømme langt ude i fremtiden. Først og fremmest handler det om at få indleveret ansøgningen og komme videre med at finde partnere, så det kommercielle potentiale kan udnyttes fuldt ud.
Apropos drømme, så lad os slutte med CEO’s ord fra præsentationen ovenpå fase 3 data i september om, at IBT bør være i stand til at få produktet registreret, og at der er historik for, at det er gjort før. ”We are here to save the babies” var den afsluttende bemærkning.
Kurs på analysetidspunkt: 44 SEK
Kursmål: 75 SEK
Analysedato: 2. april 2025
Steen Albrechtsen og/eller dennes nærtstående ejer aktier i IBT. Aktien ligger uændret i Life Science Modelporteføljen.
Steen Albrechtsen
Disclaimer: Læs her om ØU’s aktieanalyser.


Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her