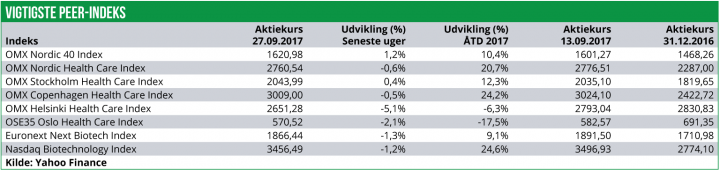
Det nordiske Life Science indeks er over de seneste to uger faldet med 0,6%, primært drevet af et sløjt performance dansk og finsk indeks.
Det finske Healthcare indeks er faldet med 5,1% mens det danske indeks er faldet med 0,5%. Det norske indeks er også i minus med et fald på 2,1%.
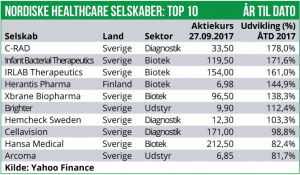
Det svenske lifescience indeks er dog steget med 0,4% og det er også her vi finder den stærkeste udvikling blandt enkelt-aktierne.
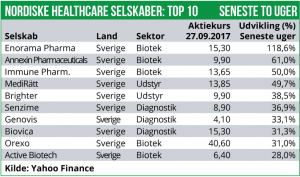
Enorama Pharma har været højdespringeren de seneste 14 dage med en stigning på 119% som følge af at man ligger i forhandlinger om en partner-aftale på den førende udviklingskandidat i pipelinen. Herudover er Annexin Pharmaceuticals steget med 61%, drevet af positive nyheder fra den prækliniske pipeline. Immune Pharmaceuticals er desuden steget 50% på positive foreløbige fase II resultater i en sjælden inflammatorisk sygdom.
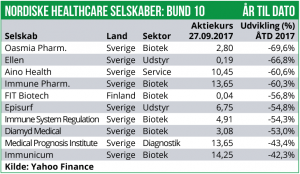
Det største kursfald har ramt Bavarian Nordic, som efter meddelelsen om fejlslagent fase III studie i prostatakræft er faldet med 36%.
ALK-Abelló har fremlagt positive fase III resultater i træpollen-allergi for dets tabletbaserede immunterapi. Studiet foretaget i otte europæiske lande inkluderede 634 patienter i alderen 12-65 år, som blev randomiseret til behandling med tabletvaccinen eller placebo. Det primære målepunkt var et en reduktion i den totale kombinerede score i birkepollensæsonen, og her viste tabletvaccinen en reduktion på 39,6% sammenlignet med placebo, hvilket var en statistisk højsignifikant forskel med en p-værdi < 0,0001. Der sås tilsvarende flotte resultater, når hele træ-pollen sæsonen inkluderedes, herunder dermed også el- og hasselpollen. ALK-Abelló forventer nu at indsende registreringsansøgning for træpollen-præparatet i Europa samt muligvis også i Canada i 2018. ALK-Abelló har desuden meddelt, at selskabets japanske partner Torii har opnået godkendelse af de japanske sundhedsmyndigheder for tabletvaccinen CEDARCURE som anvendelse mod cedertræ-allergi i patienter med høfeber relateret til cedertræ. Ca. 25% af den japanske befolkning lider af høfeber, og ca. 70% heraf lider specifikt af japansk cedertræsallergi. ALK-Abelló vil modtage løbende royalties af Toriis japanske salg. ALK-Abelló har dog også haft en negativ nyhed i Europa. Selskabets produktionsfacilitet i Vandeuil, Frankrig er blevet midlertidigt lukket ned af myndighederne i forbindelse med opdagelsen af en kontaminering af rum-miljøet på fabrikken, hvor injektionsbaserede SCIT-produkter og priktest til det franske marked produceres – dog kun svarende til mindre end 0,5% af ALK-Abelló samlede salg. Derfor forventes kun en mindre negativ effekt på omsætningen, men til gengæld vil man også have højere omkostninger forbundet med de nødvendige opgraderinger af kvalitetssystemet på fabrikken i Frankrig. Vores vurdering er at skaden er relativ begrænset og ikke noget der får større indflydelse på ALK-Abellós finanser for 2017. ALK-Abelló aktien er faldet med 2%, men er fortsat i +7% siden begyndelsen af året.
Annexin Pharmaceuticals har fået godkendelse til at producere det humane rekombinerede protein, Annexin A5 – kendt under udviklingsnavnet ANXV – til anvendelse i kliniske forsøg i mennesker. Produktionen varetages af Richter Helm Biologics GmbH & Co. KG i Tyskland. Dermed er Annexin Pharmaceuticals det første selskab i verden, der får produktions-godkendt et Annexin A5 præparat til anvendelse i menneske-forsøg. ANXV har vist effekt i prækliniske studier i forhold til beskyttelse og reparation af inflammation i blodkar. Fase I studier ventes påbegyndt i Q2 2018. Annexin Pharmaceuticals har også meddelt, at et lægeteam ved University of Alabama, USA, er lykkes med at identificere, at en mutation i Annexin A5 proteinet efter alt at dømme er årsag til at en patient tilknyttet hospitalet lider af alvorlig og tilbagevendende hjertesygdom. Kan Annexin Pharmaceuticals bekræfte dette i de kommende kliniske studier med ANXV, vil det være banebrydende. Annexin Pharmaceuticals aktien har reageret kraftigt positiv på ANXV-nyhederne og er steget med 61%. Dermed er aktien nu i et samlet plus på 2% for 2017.
AstraZeneca har afrapportet positive top-line fase III resultater (PINNACLE 4 studiet) for Bevespi Aerosphere i patienter med Chronic obstructive pulmonary disease (COPD). I sammenligning med placebo viste Bevespi Aerosphere en statistisk signifikant forbedring i lungefunktionen (FEV1). I alt er 1756 patienter optaget i studiet, som strakte sig over en 24-ugers behandlingsperiode. På baggrund af de positive effektresultater, samt en positiv safety-profil vil AstraZeneca nu ansøge om godkendelse af Bevespi Aerosphere i Japan og Kina. I forvejen er lægemidlet godkendt i USA og desuden ventes en regulatorisk beslutning at finde sted i EU i 2.halvår 2018. AstraZeneca har desuden offentliggjort et salg af dets resterende aktiver inden for anæstesi til Aspen Global Incorporated (AGI). Der drejer sig om et salg af anæstesi-præparaterne Diprivan, EMLA, Xylocaine/Xylocard/Xyloproct, Marcaine, Naropin, Carbocaine og Citanest. AGI betaler 555 mio. USD til AstraZeneca for at overtage rettighederne til disse produkter, og desuden vil AstraZeneca kunne modtage yderligere 211 mio. USD såfremt specifikke salgsmål nås. Frasalget af anæstesi-produkterne er et led i AstraZenecas strategi om at fokusere dets forretning inden for de tre lægemiddel-områder onkologi, kardiovaskulære/metaboliske samt respiratoriske sygdomme. AstraZenecas aktiekurs er steget med 4% og er nu i +9% siden Nytår.
Bavarian Nordic meddelte om aftenen d. 14. september, at fase III studiet PROSPECT foretaget i 1297 patienter med metastatisk hormon-resistent prostatakræft behandlet med cancer-vaccinen PROSTVAC, er blevet afbrudt som følge af manglende effekt i forhold til placebo-kontrolarmen. Bavarian Nordic har endnu ikke fremlagt konkrete resultater, og det er blot blevet meddelt, at den uafhængige data-komité som overvåger studiet, har anbefalet at forsøget afbrydes for ”futility”, dvs. manglende effekt. Vi forventer, at Bavarian Nordic på et senere tidspunkt vil offentliggøre de detaljerede forsøgsresultater fra PROSPECT-studiet. Så sent som i seneste udgivelse af Økonomisk Ugebrev Biotech gentog vi, at der efter vores vurdering var ca. 90% sandsynligt at forsøget ville fejle. Vi har i en længere årrække udtrykt meget stor skepsis omkring dette studie, som efter vores vurdering var baseret på ekstremt usikre fase II data. I en analyse udgivet i april 2011, var vi det første analysehus der gjorde markedet opmærksom på, at fase II studiet på ingen måde var så positivt som Bavarian Nordic gjorde det til og vi advarede Bavarian Nordic mod at igangsætte det nu fejlede fase III studie. I fase II studiet fandt vi massive randomiserings-skævheder og vi fandt dermed, at hovedårsagen til den længere overlevelse i fase II med PROSTVAC i forhold til placebo, skulle findes i en særdeles skæv randomisering af patienterne mellem de to behandlingsarme. Bavarian Nordic har dog også præsenteret et par langt mere positive nyhed. Således har man i fase IIa studiet med respiratory syncytial virus (RSV) vaccinen MVA-BN RSV, observeret et fortsat immunrespons 6 må-neder efter behandlingens afslutning. I forsøget indgår 421 raske frivillige i alderen 55+. Bavarian Nordic forventer dog først i 2.halvår 2018 at opstarte et decideret fase IIb studie med vaccinen, hvor man vil teste i syge RSV-patienter. Onsdag aften d. 27. september offentliggjorde Bavarian Nordic desuden en ny ordre fra USA for koppevaccinen IMVAMUNE. Der er tale om en ordre for den ny frysetørrede version af IMVAMUNE, og kontrakten er på 100 mio. USD (ca. 650 mio. DKK). Der er tale om råmateriale leverancer til USA i første omgang. Der indgår desuden optioner på yderligere 439 mio. USD (ca. 2800 mio. DKK), bundet op på omstilling af det leverede IMVAMUNE-råmateriale til deciderede doser til lageropbevaring. Bavarian Nordic vil samtidig investere 75 mio. USD (ca. 475 mio. DKK) i dets produktionsfacilitet i Danmark, der vil muliggøre, at råmaterialet kan omdannes til enkelt-doser til lageropbevaring. Bavarian Nordics aktiekurs er dog faldet drastisk over de seneste to uger som følge af det fejlslagne forsøg med PROSTVAC. Aktien er i -36%, men er dog fortsat i +11% siden årsskiftet.
Enorama Phama har d. 27. september udsendt en børsmeddelelse omkring ongoing forhandlinger om en aftale for dets nikotin-baserede tyggegummi, som fortsat befinder sig i klinisk afprøvning. Selskabet meddeler, at man ligger i afsluttende forhandlinger med et selskab omkring en aftale for vigtige markeder, som vil indebære indtægter til Enorama Pharma samt mindske egne udviklingsomkostninger. En nærmere tidshorisont for hvornår aftalen kan offentliggøres, hvis i det hele taget, kan ikke præciseres. Markedet har reageret stærkt positivt på nyheden og har sendt Enorama Pharma aktien i vejret med 119%. Dermed er aktien i +70% siden Nytår.
Genmab har modtaget markedsgodkendelse i Japan for CD38-antistoffet Darzalex i behandlingen af relapsed eller refractory Multiple Myeloma. Darzalex er godkendt i kombination med et af de to etablerede Multiple Myeloma lægemidler Velcade og Revlimid. Ved første kommercielle salg i Japan vil Genmab nu modtage en milepælsbetaling på 25 mio. USD (ca. 160 mio. DKK) fra den globale Darzalex-partner Janssen. Genmab aktien er dog faldet med 4%, men er fortsat i +19% for hele 2017.
Getinge Group har meddelt udfaldet af en Rights Issue emission med fortegningsret for eksisterende aktionærer. Emissionen blev tegnet med 99,2%. Gennem udstedelse af 34,05 mio. nye aktier har Getinge Group derved rejst et brutto-provenu på ca. 4,32 mia. SEK. Det samlede antal aktier i selskabet stiger med ca. 14% til 272,4 mio. aktier udestående. Getinge Groups aktiekurs er faldet med 1% og er i +3% siden begyndelsen af året.
Medivir har annonceret positive fase IIa resultater med slidgigt-midlet MIV-711. I studiet som omfattede 244 patienter og foregik over en behandlingsperiode på 6 måneder, demonstrerede MIV-711 betydelig effekt i patienter med moderat slidgigt i knæene. Således sås 65% (p<0,005) mindre progression i slidgigten på knæet i forhold til placebo og samtidig sås 70% mindre tab af brusk i knæet i forhold til placebo. Forsøget missede dog det primære målepunkt som var en reduktion i smerterne målt på Numerical Rating Scale (NRS) efter 6 måneders behandling. Dos sås en klar trend i retning af færre smerter målt via NRS for MIV-711 i forhold til placebo. Medivir forventer at præsentere de fulde resultater på en medicinsk konference i den nærmeste fremtid. Medivir har desuden meddelt, at man ikke selv ønsker tage MIV-711 i fase III, da man nu er fokuseret inden for det onkologiske felt. Medivir har sat en proces igen for at finde en partner på MIV-711 programmet. Medivir-aktien er steget med 9%, men er fortsat i et minus på 29% for hele året.
Novo Nordisk har meddelt, at de kinesiske sundhedsmyndigheder CDFA har godkendt ny-generation basal-insulinen Tresiba (degludec) som en behandling mod diabetes. Over 100 millioner mennesker i Kina har diabetes, hvilket gør det kinesiske marked til det numerisk klart største i verden målt på antal af patienter. Novo Nordisk forventer at lancere Tresiba i Kina i Q1 2018. Novo Nordisk har også fremlagt nye resultater fra det store kardiovaskulære sikkerhedsstudie DEVOTE, som viser at type 2 diabetikere, som oplever alvorlige tilfælde af hypoglykæmi (for lavt blodsukker) har 4 gange så stor risiko for at dø 15 dage efter episoden er indtruffet og 2½ gang større risiko generelt set efterfølgende. DEVOTE-studiet viste, at Tresiba reducerer risikoen for alvorlige tilfælde af hypoglykæmi med 40% i forhold til Lantus. Novo Nordisks aktien er uændret over de seneste 14 dage og dermed er aktien fortsat i +36% for 2017.
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her