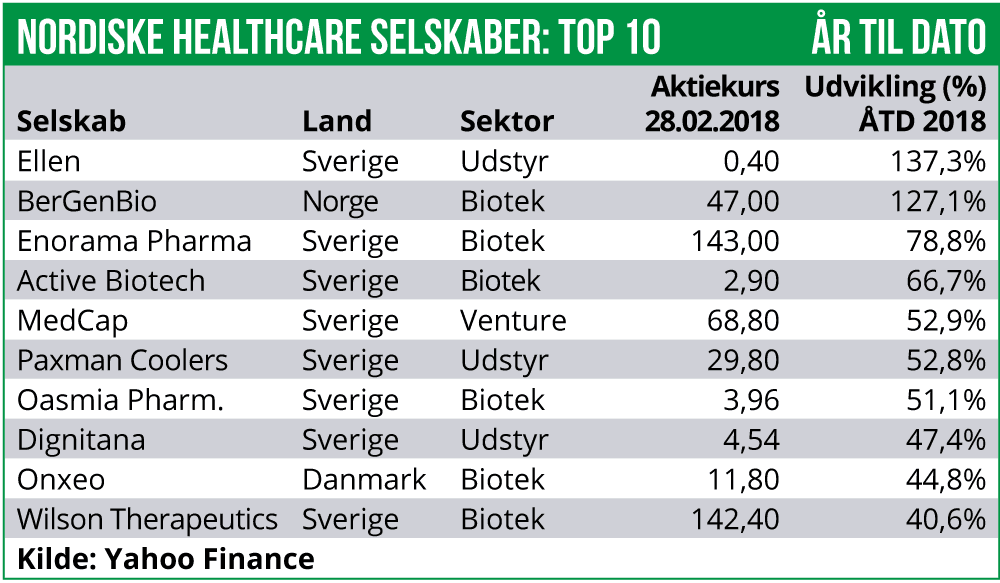
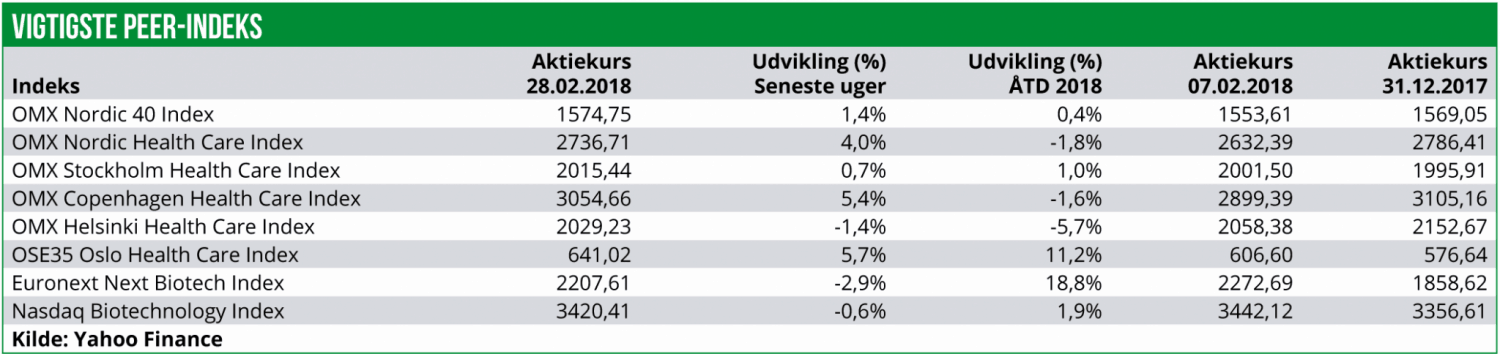
Efter det drastiske fald på 9% ultimo januar og primo februar, har den nordiske Healthcare sektor rettet sig noget og er steget med 4,0% de seneste tre uger.
Det er særligt det danske og den norske Healthcare indeks, der har drevet hele sektoren op via stigninger på hhv. 5,4% og 5,7%. Derimod er den finske Healthcare indeks faldet med 1,4%, mens det svenske Healthcare indeks er steget med moderate 0,7%.
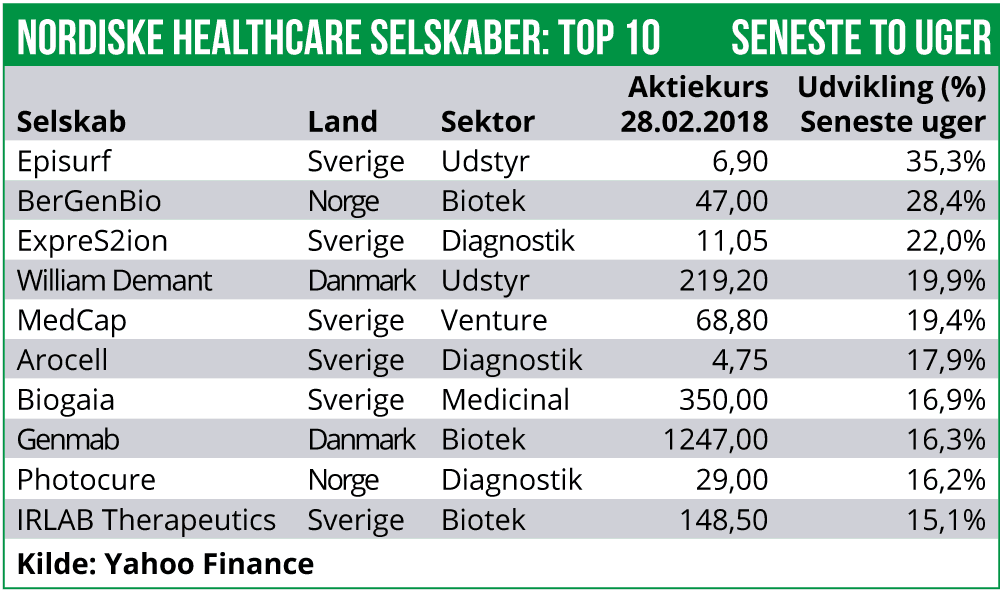
Blandt selskaberne har Episurf Medical været højdespringeren med en stigning på 35%. Selskabet har blandt andet fremlagt en ny strategi, hvor man indgyder forventninger om at man på den lange bane kan levere en EBIT-margin på 40%.
Også BergenBio har performet flot og er steget med 28%. Selskabets aktie stiger på forhåbninger til dets cancer-pipeline, hvor der løbende afrapporteres fase II data.
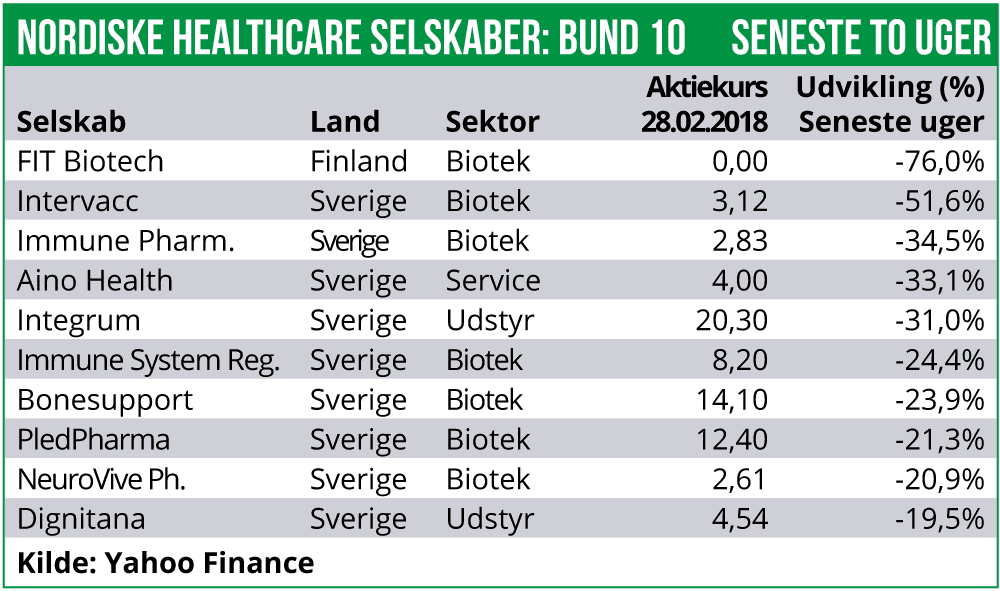
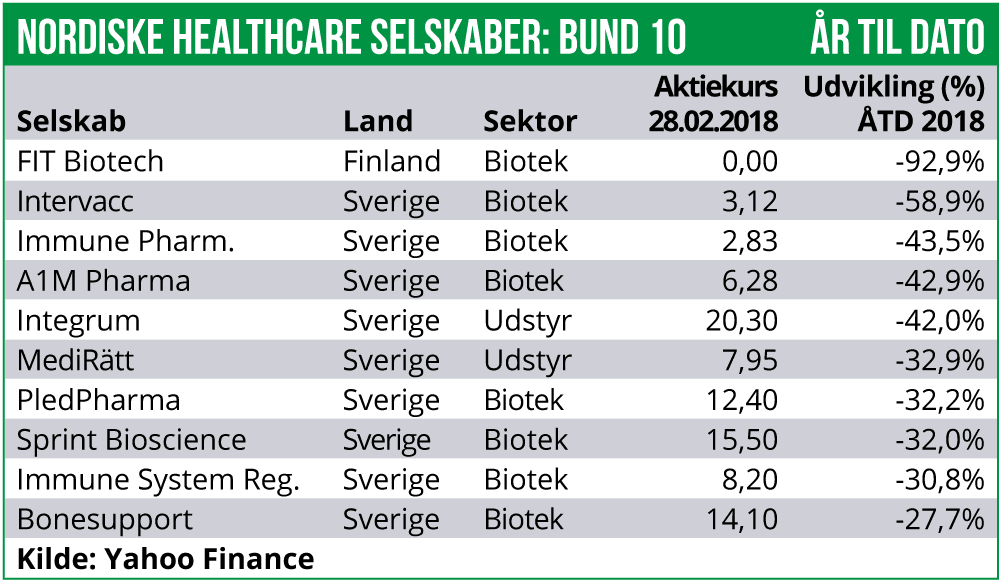
Det største kursfald har finske FIT Biotech stået for med et fald på 76% forårsaget af fortsat voldsom aktieudvanding. Desuden er Immune Pharmaceuticals faldet med 34%. Selskabet har længe ikke været i overensstemmelse med reglerne for børsnotering og nu har Nasdaq Stockholm taget konsekvens og valgt at afnotere selskabet. Sidste handelsdag vil være i slutningen af marts.
AstraZeneca har fået PD-L1 antistoffet, Imfinzi (durvalumab) godkendt af FDA som behandling mod stadie III ikke-opererbar non-small cell lung cancer (NSCLC) efter forudgående behandling med kemo- og stråle-terapi. Det anslås at ca. 30% af alle opdagede tilfælde af NSCLC befinder sig i stadie III. Godkendelsen er baseret på Fase III studiet PACIFIC, som viste en forøgelse af progressions-fri-overlevelse fra 5,6 måneder i placebo-armen til 16,8 måneder med Imfinzi. Dette modsvarer en risiko-reduktion på 48% i forhold til sygdomsprogression eller død.
Interessant er det endvidere, at resultaterne ikke var afhængigt af hvorvidt PD-L1 var udtrykt i patienterne. Endvidere meddeler AstraZeneca, at PARP hæmmeren Lynparza har fået en positiv anbefaling af de europæiske sundhedsmyndigheders ekspertudvalg CHMP. Dermed er Lynparza indstillet til godkendelse som vedligeholdelses-behandling af patienter med ovarie-cancer, hvor patienterne fortsat responderer på forudgående platin-baseret kemoterapi. Den positive anbefaling er baseret på to studier, der påviste at Lynparza reducerer risikoen for sygdomsprogression med 65-70% i sammenligning med placebo-behandling. Endelig har AstraZeneca meddelt, at MEK 1/2 hæmmeren selumetinib har modtaget Orphan Drug Designation i USA for indikationen neurofibromatose Type1 (NF1).
Neurofibromatose type 1 og 2 er to forskellige sygdomme, som skyldes mutation i neurofibromin genet. Neurofibromatose 1 er hyppigst og kaldes også von Recklinghausens sygdom. De væsentligste symptomer på sygdommen er lokaliseret til hud, øjne og nervesystemets bindevæv (neurofibromer) og sjældnere i knoglerne. Der ventes fase II resultater for selumetinib i 2018. AstraZeneca-aktien er steget med 2% de seneste tre uger og er nu i -3% siden Nytår.
Episurf Medical har sikret sig ekstern finansiering på i alt 70 mio. SEK., via udstedelse af et konverterbart obligationslån med tilknyttede warrants. Episurf kan over en periode på 36 måneder trække på lånet i rater af 7 mio. SEK. Aftalen er indgået med European Select Growth Opportunities Fund, som er fokuseret i at levere kapital til mindre vækstselskaber inden for teknologi og Healthcare. Eksisterende aktie-ejere vil modtage gratis warrants for at beskytte dem mod aktie-udvanding. Kapitaltilførslen skal man blandt andet anvendes på at udvide pipelinen til med et Episealer-baseret ankel-implantat. Desuden planlægger selskaber at iværksætte et afsluttende klinisk studie med dets Episealer knæ-implantat. Episurf Medical aktien er steget med 35% og dermed i +28% siden starten af året.
Hansa Medical har fremlagt foreløbige resultater fra et afsluttende multi-center studie (Highdes) med IdeS. I alt er 18 patienter optaget i studiet og det oplyses, at samtlige 18 patienter har gennemgået nyre-transplantation efter forudgå-ende behandling med IdeS som har muliggjort transplantationen ved at modellere patientens antistof-baserede immunforsvar, således at det nye organ ikke afstødes. Der foreligges foreløbige data fra 7 patienter, som viser, at alle 7 har en fungerende ny nyrefunktion efter 5,5 måneder. Der ventes resultater fra alle 18 patienter i Q3 2018. Vi vurderer fortsat, at Hansa Medical er på rette vej her, og vi ser en godkendelse af IdeS i 2019 som meget sandsynlig. Markedspotentialet er relativt stort, da Hansa Medicals teknologi i langt højere grad end det er muligt nu, vil muliggøre transplantation af afdøde personers organer. 2 ud af 3 donorer er afdøde. Hansa Medical meddeler desuden, at man har modtaget Orphan Drug Designation for IdeS som en mulig behandling af Guillain-Barré syndrome (GBS). GBS syndrom er en akut opstået nervebetændelse, som starter med at ramme musklerne i fødder og underben, for siden at inddrage muskler i lår, hofte, krop og mindre hyppigt arme. I sjældne tilfælde kan øjenmuskler også være lammet, hvilket kaldes Miller-Fishers
syndrom. 1-2 personer ud af 100.000 rammes årigt af GBS. I februar 2017 fremlagde Hansa Medical prækliniske data der påviste, at behandling med IdeS førte til en signifikant forbedring i det perifere nervesystem. Hansa Medicals aktien er dog faldet med 11% og er dermed i -9% siden årsskiftet.
NeuroVives bestyrelse har foreslået gennemførelse af en emission i april måned med fortegningsret for eksisterende aktionærer med en tegningskurs på 2,00 SEK per ny aktie. Fuldtegnes emissionen vil det indbringe et brutto-provenu på 78,5 mio. SEK. Der er desuden knyttet warrants til emissionen, hvilket såfremt de siden udnyttes kan indbringe yderligere 37,3 mio. SEK. Emissionen er 70% garanteret af NeuroVives nuværende større aktionærer. Emissionens gennemførelse er betinget af godkendelse på en ekstraordinær generalforsamling d. 22. marts. Gennemføres emissionen påtænker NeuroVive at anvende provenuet til at finansiere videre klinisk udvikling af KL1333 i genetiske mitokondrie-sygdomme samt finansiere et forestående fase II med NeuroSTAT i traumatic brain injury. NeuroVives aktien er faldet med 21% og er dermed i -13% for 2018 som helhed.
Novo Nordisk oplyser at de europæiske sundhedsmyndigheder har godkendt GLP1-peptidet Ozempic (Semaglutide) som en once-weekly behandling i diabetes type 2. Ozempic er godkendt dels som monoterapi, hvor metformin ikke er hensigtsmæssig og dels i kombination med anden diabetes-medicin. Novo Nordisk forventer dog først at lancere Ozempic på markedet i de første europæiske lande i løbet af 2.halvår 2018, da man ønsker at afvente myndighedernes accept af en ny multidose-pen (Ozempic pen) Lanceringen af Ozempic forventes at finde sted i de første EU-lande i andet halvår af 2018 efter godkendelsen af multidose-pennen. I december 2017 blev Ozempic godkendt i USA, og lanceres på det amerikanske marked her i 1.halvår 2018. Novo Nordisk har desuden indsendt registreringsansøgninger til både de europæiske og de amerikanske sundhedsmyndigheder for bløder-medicinen N8-GP, som en behandling mod hæmofili type A. N8-GP er en langtidsvirkende faktor VIII præparat med en forlænget halveringstid.
Fase III programmet Pathfinder omfattede over 250 patienter med hæmofili type A og undersøgte effekt og sikkerhed af N8-GP hos voksne og børn samt i forbindelse med kirurgiske indgreb. Resultaterne viste en drastisk reduktion i bløder-frekvensen blandt patienter behandlet forebyggende med N8-GP. Her sås en årlig bløderfrekvens på 1,3 episoder, mens der sås 30,9 episoder i patienter, som blot modtog akut behandling. N8-GP indgik desuden i 45 operationer, hvoraf responsen blev vurderet som tilfredsstillende i forhold til at stoppe blødninger i 43 af disse operationer. Desuden har studierne i pathfinder-programmet vist, at N8-GP er både sikkert og veltolereret. Vi har i februar måned også fået resultater fra det første fase III studie fra Novo Nordisks omfattende PIONEER-program, hvor oral semaglutide afprøves i behandlingen af diabetes type 2. Oral semaglutide er en GLP-1-analog, der tages én gang dagligt som en tablet. Det globale PI-ONEER-1 studie forløb over 26-uger og inkluderede ca. 700 personer med diabetes type 2. 3 forskellige doser af oral semaglutide (3, 7 og 14 mg) blev holdt op imod placebo. Data var ordentligt positive og viste således at blodsukkerreduktion målt via HbA1c var dosisafhængig og viste et fald på 0,8%, 1,3% og 1,5% for de respektive semaglutide doser.
I placebo-gruppen sås en blodsukkerreduktion på 0,1%. Der sås desuden et vægttab blandt semaglutide-behandlede patienter på hhv. 1,7 kg, 2,5 kg og 4,1 kg, mod 1,5 kg i placebo-gruppen. Novo Nordisk udtrykker også tilfredshed med bivirkningsprofilen, som fremstod god med en lav drop-out rate og kvalme, som den største bivirkning i forhold til placebo (5-16% mod 6% i placebo-gruppen). PIONEER programmet består af 10 studier, hvor i alt 9000 patienter indgår. Der ventes resultater fra samtlige øvrige fase III studier under programmet i løbet af 2018. Novo Nordisk har reageret positivt på de seneste ugers positive nyhedsstrøm og er steget med 4%. Aktien er dog fortsat i et minus på 5% for hele året.
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her










