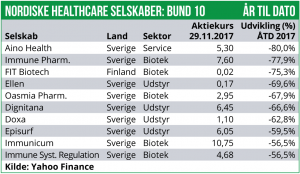
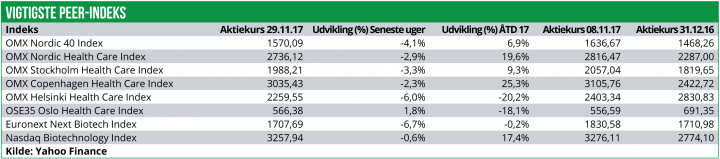
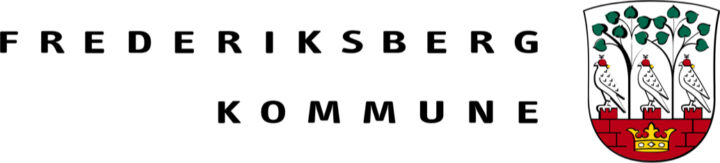Nyhedsanalyse: Over de seneste tre uger har den nordiske healthcare-sektor været under pres og indekset er faldet med 2,9%.
Det er særligt det finske Healthcare indeks, der har været presset med et fald på 6,0% samt den svenske sektor med et fald på 3,3%. Det danske indeks er også faldet, men med mere moderate 2,3%, hvilket kan tilskrives, at Novo Nordisk fortsat holder dampen oppe og faktisk er steget med 0,7%. Det norske Healthcare indeks er med et plus på 1,8% gået mod strømmen.De seneste uger har været præget af fald i det generelle aktiemarked, og en række nordiske Healthcare-selskaber har desuden bebudet kapital-rejsninger, hvilket har presset markedet yderligere.
Blandt selskaberne har Dignitana været højdespringeren med en stigning på 104% efter annonceringen af at man flytter sit hovedkvarter til USA, hvilket formodes at styrke de kommercielle udsigter. Desuden er Immunicum steget med 34% efter positive prækliniske cancer-data og PledPharma er steget med 28%, som følge af fremskridt med det primære pipeline-aktiv PledOx.
I den kedelige ende finder vi RLS med et fald på 39%. Også IBT er faldet med kraftigt med 21% ovenpå annonceringen af en omfattende emission.
 AstraZeneca har indsendt registreringsansøgning for Tyrosine Kinase Inhibitor (TKI) medikamentet Tagrisso i Japan. Ansøgningen dækker 1st line behandlingen af patienter med EGFR muteret Non-Small Cell Lung Cancer (NSCLC). I fase III (FLAURA studiet) viste Tagrisso en statistisk signifikant længere progressionsfri-overlevelse (PFS) sammenlignet med den nuværende EGFr-standard terapi Tarceva eller Iressa. I Europa er en tilsvarende registreringsansøgning for Tagrisso under behandling og her er det i november blevet meddelt, at EMA nu har accepteret selve ansøgningen, hvorfor selve behandlingen af ansøgningen nu indledes. I USA har AstraZeneca endvidere modtaget markedsgodkendelse af to registreringsansøgninger. Faslodex er blevet godkendt i kombination med CDK4/6 hæmmeren abemaciclib i behandlingen af hormon-receptor positiv/HER2 negativ fremskreden eller metastatisk brystkræft.
AstraZeneca har indsendt registreringsansøgning for Tyrosine Kinase Inhibitor (TKI) medikamentet Tagrisso i Japan. Ansøgningen dækker 1st line behandlingen af patienter med EGFR muteret Non-Small Cell Lung Cancer (NSCLC). I fase III (FLAURA studiet) viste Tagrisso en statistisk signifikant længere progressionsfri-overlevelse (PFS) sammenlignet med den nuværende EGFr-standard terapi Tarceva eller Iressa. I Europa er en tilsvarende registreringsansøgning for Tagrisso under behandling og her er det i november blevet meddelt, at EMA nu har accepteret selve ansøgningen, hvorfor selve behandlingen af ansøgningen nu indledes. I USA har AstraZeneca endvidere modtaget markedsgodkendelse af to registreringsansøgninger. Faslodex er blevet godkendt i kombination med CDK4/6 hæmmeren abemaciclib i behandlingen af hormon-receptor positiv/HER2 negativ fremskreden eller metastatisk brystkræft.
Kombinationsbehandlingen viste i fase III studiet en forlængelse af PFS med 7,1 måneder sammenlignet med Faslodex alene. Desuden har AstraZeneca fået FDA-godkendt astma-medicinen Fasenra (benralizumab) i patienter med eosinofil astma. Fasenra binder til IL-5a receptoren, som udtrykkes på de hvide blodlegemer af typen eosinofil, som typisk forbindes med allergiske reaktioner. Fase III programmet viste en reduktion på 51% i antallet af astma-udbrud for Fasenra sammenlignet med placebo, samt en 75% reduktion i anvendelsen af orale steroider. I Europa er Fasenra d. 10. november endvidere blevet indstillet til godkendelse af CHMP, lægeudvalget som er underlagt EMA. AstraZeneca aktien er uændret over de seneste tre uger og er dermed fortsat i +12% for hele 2017.
Bavarian Nordic har iværksat en forlængelse af et allerede gennemført fase II studie med Respiratory Syncytial Virus (RSV) vaccinen MVA-BN RSV. I det oprindelige fase II studie blevet 421 raske frivillige behandlet med MVA-BN RSV og i det forlængede fase II studie vil 86 af disse patienter blive behandlet med yderligere en booster af vaccinen. Formålet med studiet er at få afdækket om en enkelt vaccinering med MVA-BN RSV er til tilstrækkeligt til at opnå et flerårigt immunrespons eller om en årlig booster er nødvendig. Det er hensigten i 2018 at iværksætte et fase IIb forsøg i egentlige RSV-patienter.
Bavarian Nordic har desuden meddelt, at de amerikanske myndigheder har valgt at udnytte en option til en værdi af 37 mio. USD, som skal dække Bavarian Nordics omkostninger forbundet med fase III afprøvning af den frysetørrede version af 3. generations koppevaccinen IMVAMUNE. I den forbindelse har Bavarian Nordic afholdt et såkaldt end-of-phase-2 meeting med FDA og her står det klart, at blot et enkelt fase III studie i raske frivillige er tilstrækkelig for at kunne indsende registreringsansøgning for den frysetørrede IMVAMUNE version. Bavarian Nordics aktiekurs er dog falde med 12% de seneste uger og er nu i -7% siden Nytår.
 Biovica har på San Antonio Breast Cancer Symposium konferencen præsenteret resultater fra et diagnostisk studie med 142 nyligt diagnosticerede patienter med metastatisk brystkræft. I studiet blev Biovicas blodprøve-baserede biomarkør DiviTum testet i forhold til at afdække, hvorvidt den medicinske behandling bestående af fx kemoterapi og Herceptin havde effekt i patienterne. Allerede efter 1 måned kunne DiviTum afdække behandlingseffekten i patienterne med en p-værdi på < 0,001. Dette står i kontrast til de nuværende effekt-værktøjer bestående af fx CT-scanning, hvor valide og troværdige resultater først kan opnås efter ca. 3 måneder.
Biovica har på San Antonio Breast Cancer Symposium konferencen præsenteret resultater fra et diagnostisk studie med 142 nyligt diagnosticerede patienter med metastatisk brystkræft. I studiet blev Biovicas blodprøve-baserede biomarkør DiviTum testet i forhold til at afdække, hvorvidt den medicinske behandling bestående af fx kemoterapi og Herceptin havde effekt i patienterne. Allerede efter 1 måned kunne DiviTum afdække behandlingseffekten i patienterne med en p-værdi på < 0,001. Dette står i kontrast til de nuværende effekt-værktøjer bestående af fx CT-scanning, hvor valide og troværdige resultater først kan opnås efter ca. 3 måneder.
Biovica har også fremlagt resultater for et studie i 404 patienter med den aggressive pancreas cancer, der tilsvarende viste, at DiviTum kan anvendes som en valid markør for behandlingseffekt. Biovica har desuden fået publiceret DiviTum-resultater i journalen Breast Cancer Research and Treatment for et studie, hvor DiviTum testedes i forhold til at måle behandlingseffekten af Pfizers brystkræftmedicin Ibrance (palbociclib). Her kunne DiviTum allerede efter 2 uger nøjagtigt fastslå om behandlingen med Ibrance var effektiv i de 50 testede patienter med brystkræft. DivuTum måler aktiviteten af thymidine kinase, hvilket er en markør for celle-deling og dermed tumorvækst. Biovicas aktiekurs har reageret med en stigning på 10% på de stærke DiviTum resultater. Dermed er aktien nu i +17% siden årsskiftet.
 Cantargia har annonceret gennemførelsen af en garanteret rettet emission samt en emission med fortegningsret for eksisterende aktionærer til en samlet værdi på i alt 232 mio. SEK. Den rettede emission er på 101 mio. SEK og betyder at en række investeringsfonde nu træder ind i aktien. Fondene omfatter First AP Fund, Second AP Fund, Fourth AP Fund, Nordic Cross Stable Return og Handelsbanken Läkemedelsfond. Emission med fortegningsret for eksisterende aktionærer er på 131 mio. SEK og her har den næststørste aktionær Sunstone Life Science Ventures meddelt, at man vil deltage med tegning af aktier for 25 mio. SEK. Desuden har en række øvrige større aktionærer indvilliget i at tegne aktier for ca. 15. mio. SEK.
Cantargia har annonceret gennemførelsen af en garanteret rettet emission samt en emission med fortegningsret for eksisterende aktionærer til en samlet værdi på i alt 232 mio. SEK. Den rettede emission er på 101 mio. SEK og betyder at en række investeringsfonde nu træder ind i aktien. Fondene omfatter First AP Fund, Second AP Fund, Fourth AP Fund, Nordic Cross Stable Return og Handelsbanken Läkemedelsfond. Emission med fortegningsret for eksisterende aktionærer er på 131 mio. SEK og her har den næststørste aktionær Sunstone Life Science Ventures meddelt, at man vil deltage med tegning af aktier for 25 mio. SEK. Desuden har en række øvrige større aktionærer indvilliget i at tegne aktier for ca. 15. mio. SEK.
Såfremt emissionen med fortegningsret ikke fuldtegnes vil de tilbageværende aktier blive tegnet af eksisterende aktionærer. Hele emissionen foretages til kurs 6,80 SEK per aktie og repræsenterer således en mindre rabat i forhold til den aktuelle markedskurs. I alt vil der dermed blive udstedet 34,1 mio. nye aktier, hvilket repræsenterer en aktieudvanding på ca. 106% i forhold til det eksisterende antal udestående aktier. Tegningsperioden løbet fra 1-15. december. Formålet med denne meget omfattende emission er at sikre gennemførelsen af en række fase I/II studier i lungekræft (NSCLC) og pancreas cancer med cancer-antistoffet CAN04, som er rettet mod IL1-RAP (Interleukin 1 Receptor Accessory Protein). Kapitalrejsningen sikrer desuden Cantargias drift frem til 2020. Vi har i lang tid advokeret for at CAN04 er et meget lovende antistof og den store interesse for at tegne aktier i selskabet blandt institutionelle investorer, synes nu at bakke op om dette synspunkt.
Det er dog bemærkelsesværdigt, at Cantargia for mindre end et års tid siden havde store problemer med at fuldtegne en emission på ca. 100 mio. SEK og nu tilsyneladende uden de store problemer kan rejse mere end det dobbelte i to stk. garanterede emissioner. Vi forventer fortsat en kraftig værditilvækst i selskabets aktiekurs over de kommende kvartaler. Der ventes løbende resultater fra fase I studiet med CAN04 i NSCLC over de kommende måneder. Cantargias aktiekurs er faldet med 13% de seneste tre uger, men er dog fortsat i +12% for hele 2017.
Genmab har modtaget en milepælsbetaling på 20 mio. USD fra partneren Janssen i forbindelse med fremskridt i et fase III studie med CD38-antistoffet Darzalex i sygdommen Amyloidose. Dette er den første fase III milepælsbetaling modtaget i sygdomsindikationer uden for Myelomatose. Darzalex testes i amyloidose i kombination med Velcade og Cyclophosphamid. Tidligere i november modtog Genmab også en salgs-milepæl på 50 mio. USD relateret til, at det kommercielle salg af Darzalex nu har rundet 1 mia. USD årligt. Endvidere har det første kommercielle salg af Darzalex i Japan nu fundet sted, hvilket har kastet yderligere en milepælsbetaling på 25 mio. USD til Genmab af sig. Dermed har Genmab samlet set over den seneste måned modtaget milepælsbetalinger på 95 mio. USD fra Janssen. Endelig har Genmab og Janssen indsendt registreringsansøgninger for Darzalex til både de europæiske og amerikanske sundhedsmyndigheder for Darzalex som 1st line behandling af Myelomatose.
I fase III ALCYONE studiet blev Darzalex testet i kombination med standardbehandling VMP bestående af Velcade, kemoterapien Melphalan samt prednisolon. Studiet bestod af 706 nyligt diagnosticerede patienter og viste en reduktion i risikoen for sygdomsprogression (PFS) på 50% og med en meget overbevisende p-værdi på <0,0001. Genmab og Janssen vil på en oral præsentation d. 12. december præsentere de detaljerede forsøgsresultater på årets ASH konference. Genmab har haft en meget stærk november, men på trods heraf er aktiekursen under pres, naturligvis forårsaget af et generelt pres på aktiemarkedet. Vi ser dette som en oplagt mulighed for at akkumulere i aktien. Genmabs kurs er de seneste tre uger faldet med 2% og er nu i +2% siden årsskiftet.
 Hansa Medical har meddelt markedet, at man er i færd med at foretage en rettet emission via det så-kaldte book-building princip. Hensigten er at rejse et provenu på 545 mio. SEK gennem udstedelse af nye aktier til institutionelle investorer. Emissionsbankerne er RBC Capital Markets og SEB. Emissionens gennemførelse er betinget af godkendelse på en ekstraordinær generalforsamling som afholdes d. 22. december. På forhånd har aktionærer, der besidder totalt 44,4% af aktiekapitalen, indvilliget i at stemme for gennemførelse af emissionen.
Hansa Medical har meddelt markedet, at man er i færd med at foretage en rettet emission via det så-kaldte book-building princip. Hensigten er at rejse et provenu på 545 mio. SEK gennem udstedelse af nye aktier til institutionelle investorer. Emissionsbankerne er RBC Capital Markets og SEB. Emissionens gennemførelse er betinget af godkendelse på en ekstraordinær generalforsamling som afholdes d. 22. december. På forhånd har aktionærer, der besidder totalt 44,4% af aktiekapitalen, indvilliget i at stemme for gennemførelse af emissionen.
Hansa Medicals intention er at anvende provenuet fra emissionen på at færdiggøre de kliniske studier med IdeS i nyre-transplantationsindikationen samt iværksætte nye studier i andre beslægtede transplantations-indikationer og udvalgte akutte autoimmune sygdomme. Hansa Medicals aktiekurs er faldet ovenpå udsigten til en relativ kraftig udvanding af de eksisterende aktionærer, hvilket har sendt aktien ned med 2%. For hele året er aktien dog fortsat i et stærkt og velfortjent plus på 79%.
Infant Bacterial Therapeutics (IBT) har efter godkendelse på generalforsamlingen fået tilladelse til at gennemføre en rettet emission på 105 mio. SEK. Hertil kommer en emission med fortegningsret for eksisterende aktionærer på 440 mio. SEK, som på forhånd er 89% garanteret. Tegningsperioden vil blive i januar 2018. Formålet er at sikre selskabets drift frem til 2020, hvor man forventer markedsgodkendelse af det mælkesyrebakterie-præparat IBP-9414 rettet mod behandling af spædbarn-sygdommen Necrotizing Enterocolitis (NEC). IBT vil anvende provenuet på at gennemføre et pivotalt fase III studie med IBP-9414 i NEC-indikationen i 2018-2019.. IBT’s aktiekurs er faldet med 21%, men det skal ses i lyset af at aktien fortsat er i et meget flot plus for hele 2017 på 136%.
PledPharma har indgået en licens-aftale for PledOx med Solasia omfattende Japan, Kina, Hong Kong, Macau, Sydkorea og Taiwan. PledPharma vil kunne opnå milepælsbetalinger på i alt 83 mio. USD (700 mio. SEK), hvortil kommer royalties af salget. Desuden forpligter Solasia sig til at finansiere dele af det kliniske fase III program der omfatter asiatiske patienter. PledOx udvikles som en behandling mod neuropatiske smerter i metastatiske kolon-cancer patienter opstået som følge af kemo/stråleterapi. Det estimeres at 40-60% af alle disse patienter døjer med neuropatiske smerter. Tidligere i november offentliggjorde PledPharma selve fase III programmet for PledOx, som nu ventes iværksat inden udgangen af 2017. To stk. fase III studier med i alt 500 patienter vil blive iværksat og PledOx vil her blive testet op imod placebo.
Patienterne i studiet behandles med kemo-cocktailen FOLFOX. PledPharma vurderer, at man har tilstrækkelig med kapital til at nå i mål med data-afrapporteringen for begge disse studier, som ventes i 2020. I vores seneste analyse af PledPharma fra 26.oktober 2017, vurderede vi aktien som kraftig undervurderet og hævede vores anbefaling fra Neutral til Køb. De seneste tre uger er aktien da også steget kraftigt på de gode nyheder og er oppe med 28%. Aktien er nu også i et plus på 8% for hele 2017.
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her