Svenske BONESUPPORT udvikler og kommercialiserer injicerbare biokeramiske knogletransplantat-erstatninger baseret på teknologiplatformen CERAMENT. Virksomheden har netop modtaget FDA-godkendelse, som forventes at bidrage til yderligere salgsvækst i Nordamerika ovenpå et 1. kvartal 2022, hvor nettoomsætningen med 48 % til 66,3 mio. SEK.
Ortopædiske sygdomme og skader er den næstmest almindelige årsag til fysiske handicap. Den demografiske udvikling driver et stigende behov for behandling, da et stigende antal ældre fører til en højere forekomst af knogleskørhed kombineret med ønsket om at forblive aktiv længere og en øget idrætsaktivitet.
Det globale marked for ”bengraft” anslås at beløbe sig til 3,3 mia. USD (33,5 mia. SEK), og det vokser med omkring 5 % om året. Af dette marked udgøres cirka 39 % af godkendte indikationer for behandling med CERAMENT, hvilket giver et markedspotentiale på 1,3 mia. USD (13,2 mia. SEK). BONESUPPORT vurderer, at 25 % af dette marked ligger i USA og 25 % i de mest solgte lande i Europa, mens den resterende del ligger i resten af verden. Der er flere forskellige situationer, hvor den naturlige heling af skeletskader ikke virker. Dette kan forekomme i f.eks. komplicerede knoglebrud (traume), revisionsarthroplastik (erstatning af ledproteser), tumorer og ved infektion.
Traditionelt har ortopæder behandlet skeletskader, der ikke heler selv, ved at fylde dem med patientens eget knoglevæv transplanteret fra en andet del af skelettet (såkaldt autograft) eller gennem doneret knoglevæv (såkaldt allograft).
CERAMENT® Cermant tilbyder et alternativ, der kan bruges til at behandle ved at injicere det i knogledefekten ved hjælp af en minimalt invasiv teknik. Brugen af CERAMENT betyder dermed, at der ikke er behov for en anden kirurgisk procedure.
Kommercialisering i USA
En af de største udfordringer, når ny behandling kommer på markedet, er at sikre, at sundhedsvæsenet inddrager det i den tilbudte behandling. Værdien af en behandling bestemmes på forskellig vis i forskellige lande, og BONESUPPORT arbejder med en række forskellige aktiviteter for at sikre, at virksomhedens produkter indgår i kompensationssystemerne på de markeder, hvor produkterne markedsføres. Som vi ved fra mange andre selskaber, er det meget ofte en langvarig og bureaukratisk proces at opnå tilskud og sikre, at et produkt bliver en del af rutinerne.
Salget i USA er baseret på, at virksomheden ændrede sin distributionsstrategi for næsten tre år siden. Virksomheden underskrev da en større GPO-kontrakt (Group Purchasing Organisation), som blev udvidet med et af USA’s største indkøbsnetværk: Premier. Dette muliggjorde introduktionen af CERAMENT BVF på en række hospitaler og klinikker. Ved udgangen af 2021 havde BONESUPPORTs kommercielle organisation i USA 19 ansatte og mere end 40 distributører.

FDA-ansøgning godkendt efter lang ventetid
I marts 2020 fik CERAMENT G “Breakthrough Device Designation” af FDA i indikationen osteomyelitis (knogleinfektion) og i juni 2021 også indikationen traume. Denne kategorisering gives til produkter, der anses for at yde effektiv behandling af svære sygdomstilstande, hvor der ikke findes tilsvarende på markedet. Vi kender den fra udviklingen af lægemidler, hvor Breakthrough Therapy Designation (BTD) giver betydelige fordele. Konceptet er principielt det samme indenfor medtech, men her er den regulatoriske proces meget mindre omfattende, og derfor er de økonomiske fordele ved breakthrough device designationen betydeligt mindre end ved BTD i lægemiddelgruppen.
Formålet er at fremskynde den regulatoriske proces for medicinsk udstyr, så patienterne får hurtigere adgang til nye behandlingsmuligheder. BONESUPPORT indsendte en De Novo-ansøgning til FDA for CERAMENT G i april 2020, og oprindeligt planlagde man at indsende en regulatorisk ansøgning i bl.a. traume-indikationen inden udgangen af 2021. DeNovo-ansøgning er en ansøgningsvej/-proces, der bruges, når der ikke findes et sammenligneligt produkt på markedet.
BONESUPPORTs oprindelige plan var at lancere CERAMENT G i USA i knogleinfektioner i foråret 2021, men godkendelsesprocessen for CERAMENT G viste sig at kræve yderligere interaktioner med FDA. I februar 2021 modtog virksomheden information fra FDA om, at deres DeNovo-ansøgning om CERAMENT G ikke kunne gennemføres uden yderligere data og afklaringer. Virksomheden indsendte derefter en supplerende FDA-ansøgning i slutningen af 2021. FDA-beslutningen for De Novo-applikationen burde have fundet sted senest 28. februar 2022, men selskabet meddelte dengang, at FDA havde informeret om, at det ville blive forsinket med “et par uger” og begrundede forsinkelsen med det store antal EUA-ansøgninger (Emergency Use Authorization), der er kommet ind relateret til covid-19, i 2020 og 2021. Vi har f.eks. også set en lignende forsinkelse hos Biovica, som også blev begrundet af FDA med covid-arbejdspres.
Den 18. maj, efter lidt over to måneders venten, fik BONESUPPORT endelig markedsgodkendelse af CERAMENT G i indikationen knogleinfektion (osteomyelitis).
Stærk salgsvækst i 2021 og første kvartal af 2022
På trods af en fortsat påvirkning af covid-19-pandemien var 2021 BONESUPPORTs bedste år nogensinde med en nettoomsætning på 213 mio. SEK, hvilket svarer til en stigning på 18 % i forhold til 2020 og 44 % i forhold til 2019. For 2021 steg salget i Nordamerika med 22 %, og Europa og resten af verden (EUROW) rapporterede en salgsfremgang på 12 %. Bruttomarginen udgjorde 89 %, og driftsresultatet var -81 mio. SEK.
BONESUPPORT ser salgsvæksten som en bekræftelse af CERAMENTs klare fordele, og at den kommercielle model, de anvender, er succesfuld.
Håbet er at kunne tage en betydelig markedsandel fra andre behandlingsalternativer, og efter pandemien er overstået, er målet at øge salget med 40 % om året over de næste tre år.
I perioden januar-marts 2022 udgjorde nettoomsætningen 66,3 mio. SEK sammenlignet med 44,8 mio. SEK i det tilsvarende kvartal sidste år, hvilket betyder en stigning på 48 %. I Nordamerika steg salget med 64 %, og i EUROW steg salget med 28 %. Bruttomarginen var 90,5 % sammenlignet med 88,6 % året før, hvilket i høj grad var drevet af øget salg i Nordamerika. Driftsresultatet udgjorde -16,5 mio. SEK sammenlignet med -19,7 mio. SEK året før. I januar 2022 underskrev virksomheden en distributionsaftale med OrthoPediatrics om behandling og distribution af CERAMENT BVF til 1 pædiatrisk hospitalskæde i USA. OrtoPediatrics består af et netværk af 250 børnehospitaler. I løbet af kvartalet startede salget, og virksomheden modtog den første ordre på 2,6 mio. SEK.
Visionen er at blive en global leder
BONESUPPORT blev grundlagt i begyndelsen af 2000’erne som en forskningsvirksomhed og børsnoteret i 2017. Aktien handles på Nasdaq Stockholm.
Virksomhedens vision er at blive en global ortobiologisk leder, der kan optimere knoglebiologi. Produkterne, der udvikles, er rettet mod behandling af skelettet hos patienter med frakturer og knoglehuler forårsaget af komplicerede knoglebrud (traumer), infektion, sygdom eller operation.
Produkterne består af syntetiske knogletransplantaterstatninger under navnene CERAMENT bone void filler (BVF), CERAMENT G med gentamicin og CERMENT V med vancomycin. Alle disse er baseret på den nye og proprietære CERMENT teknologiplatform, der omformer patientens egen knogle og leverer antibiotika direkte ind i knoglen for at beskytte helingsprocessen.
Siden starten er BONESUPPORTs produkter blevet brugt i cirka 70.000 kirurgiske indgreb i mere end 20 lande, og for at verificere produkternes effektivitet gennemfører virksomheden løbende kliniske undersøgelser. I dag har virksomheden en database med mere end 240 forskningspublikationer og abstracts af prækliniske og kliniske studier med CERAMENT.
Anbefaling og kursmål
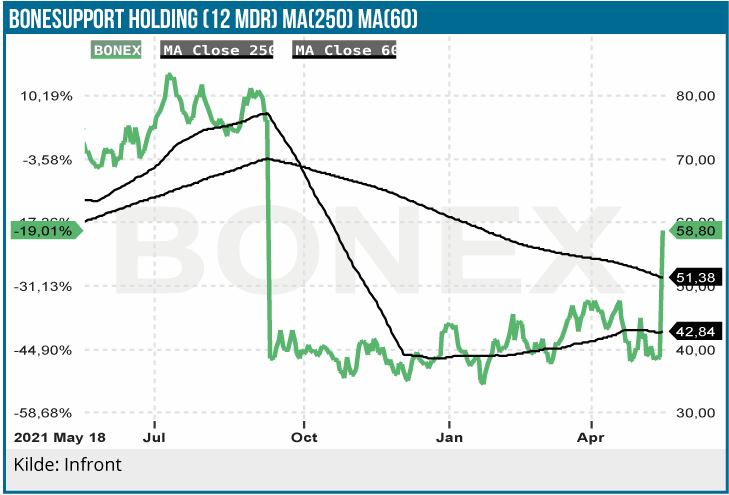
Vi er lettede over, at godkendelsen fra FDA kom før 1. juli, da den nu giver mulighed for fuld kapitalisering af NTAP (New Technology Add-on Payments), som giver adgang til forhøjet betaling pga. nyskabelsen i produktet. Den forsinkede FDA-beslutning har længe skabt usikkerhed i aktien, men vi vurderer, at aktien nu vil være i stand til at genfinde et positivt momentum. Vores vurdering er, at BONESUPPORT har et tydeligt upsidepotentiale. Der er mange medtech teknologiaktier, f.eks. Sedana Medical og Vitrolife, som har haft en skuffende start i 2022, så BONE-SUPPORT er ikke den eneste virksomhed, der har set sin værdiansættelse falde.
Aktien har dog i år indtil FDA-godkendelsen holdt sig nogenlunde omkring et relativt snævert kursinterval fra 40 til 45 SEK, hvilket i sammenligning med mange andre aktier og de generelle markeder må siges at være pænt. Aktien steg pænt på FDA-udmeldingen den 18. maj, og har dermed meldt sind i den ret eksklusive gruppe af aktier der ligger med et positivt afkast i år. Med FDA-godkendelsen på plads, vil markedet kunne begynde at se den sande værdi af denne hurtigtvoksende virksomhed igen. Med til historien om aktiekursen hører at den blev halveret i september ovenpå dårlige studiedata med Cerament G i traume-indikationen.
Ved den nuværende EV på ca. 2,7 mia. SEK handler BONESUPPORT i øjeblikket til EV/sales-multipel på 9,3x. Det kan sammenlignes med en median på 11,1 for en peergruppe af børsnoterede svenske medicintekniske virksomheder.
Det stigende fokus på det omfattende efterslæb, der er opstået i sundhedsvæsenet, bør medføre, at den elektive plejeaktivitet vil stige kraftigt i de kommende år, hvilket giver rigtig gode vækstmuligheder for BONESUPPORT.
Målet om at øge salget med 40 % om året de næste tre år ser da ikke ud til at være urealistisk. Dette understøttes af konsensustal, der indikerer vækst på 36,7 % for 2022, 34,7 % for 2023 og 72,0 % for 2024. Et andet argument for BONESUPPORTs upsidepotentiale er, at den “forsømte” efterspørgsel efter virksomhedens produkter er særlig høj i USA, hvor man har en veletableret kommerciel infrastruktur, der kan bruges i salget af CERAMENT G.
Selvom BONESUPPORTs omsætning har klaret pandemiens udfordringer pænt, kan en reduktion af elektive operationer have en helt kortsigtet indvirkning på virksomhedens salgsudvikling. Det ser vi dog ikke som en væsentlig langsigtet risiko med særligt negative konsekvenser.
Samme dag som offentliggørelsen af FDA’s godkendelse steg aktien med omkring 40 %, og efter at den måske lige skal puste ud, forventer vi en fortsat stigning i de kommende måneder.
Når vi har medtaget alle faktorer vedrørende vækst og risici i vores værdiansættelse, vil den aktuelle anbefaling være KØB med et kursmål på 70 SEK og en tidshorisont på 12 mdr.
Andrea Backlund
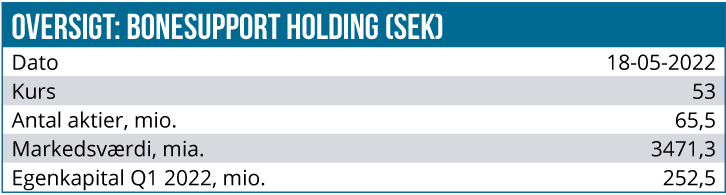
Kurs på anbefalingstidspunkt: 53,85 SEK
Kursmål: 70 SEK
Analysedato: 18. maj 2022
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her