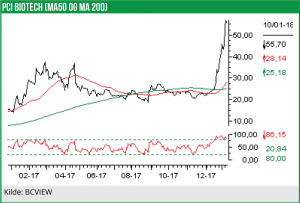
PCI Biotech aktien er startet forrygende i 2018 og er steget med ca. 30%, efter at man lige før jul fik forhandlet en overordnet ramme på plads for fase III designet for dets primære pipelineaktiv med sundhedsmyndighederne.
Siden vores seneste analyse af PC Biotech i januar 2017, hvor aktiekursen stod i 17,80 NOK er kursen næsten tredoblet. En stor del af stigningen er første tilkommet efter at PCI Biotech d. 20. december 2017 meddelte, at man har nået en foreløbig aftale med både de amerikanske og de europæiske sundhedsmyndigheder om designet af fase III studiet med FimaCHEM (fimaporfin) i kombination med den veletablerede kemoterapi Gemcitabine (Gemzar), som en 1st line behandling af ikke-operable galdegangskræft (bile duct cancer).
 Pivotalt forsøg kan starte til sommer
Pivotalt forsøg kan starte til sommer
FimaCHEM er baseret på selskabets PCI-platform og er en lokal behandlingsform, som anvender lysterapi som kilde til at forstærke effekten af eksisterende lægemidler. Hermed ”blødgøres cellemembranen og den efterfølgende kræftmedicin får nemmere ved at nå frem til sit angrebsmål, dvs. cancercellerne.
Det er aftalt med FDA og EMA, at blot ét enkelt fase III studie vil være tilstrækkeligt til efterfølgende at ansøge om registrering og dermed markedsgodkendelse af FimaCHEM. Desuden vil det foreslåede forsøgsdesign indebære, at PCI Biotech i tilfælde af positive del-resultater vil kunne afbryde studiet før tid og søge om godkendelse. Dermed vil varigheden af fase III studiet potentielt kunne nedbringes betydeligt. Der findes i dag ingen godkendte behandlinger af galdegangskræft. Gemzar er på markedet og har været det i mange år, men anvendes primært til behandling af den beslægtede pancreas cancer (bugspytkirtelkræft).
PCI Biotech forventer nu at kunne offentliggøre det detaljerede forsøgsdesign i løbet af de kommende uger således, at studiet vil kunne iværksættes inden udgangen af 1.halvår 2018.
I 3.kvartal 2017 blev FimaCHEM tildelt Orphan Drug Status af FDA, hvilket i praksis betyder, at sundhedsmyndigheder i USA vil prioritere en hurtigere behandling af det endelige forsøgsdesign og en eventuelt efterfølgende registreringsansøgning. I foråret 2017 præsenterede PCI Biotech opdaterede fase I/II resultater med FimaCHEM i inoperabel galdegangskræft (cholangiocarcinoma) i kombination med Gemcitabine. Det er disse resultater, som har ført til, at man nu vil gå i fase III her i 1.halvår 2018. De opdaterede resultater viste en median-overlevelse på 14,5 måneder samt at 25% af patienter fortsat var i live ved udgangen af marts 2017. I forhold til den kemoterapeutiske behandling med Gemzar er dette noget bedre. Gemzar har i kombination med en anden velkendt kemoterapi Cisplatin, således vist en median-overlevelse på 11,7 og 11,2 måneder.
Ved fremlæggelsen faldt PCI Biotechs aktiekurs ganske voldsomt, idet det var skuffende, at overlevelsesdata ikke var stærkere, begrundet i de tidligere fremlagte og meget stærke responsdata (57% respons). PCI Biotech pegede på, at data ikke nødvendigvis er sammenlignelige fordi forsøget med FimaCHEM har optaget en specifik type af inoperer-bare galdegangskræft-patienter. I august 2017 iværksatte PCI Biotech en udvidelse af ovenstående fase I/II studie, hvor yderligere 6 patienter vil blive optaget og vil modtage en indledende dosis FimaCHEM efterfulgt af yderligere én dosis 3-4 måneder senere. I det primære fase I/II studie modtog hver patient kun én enkelt dosis FimaCHEM. PCI Biotech vil anvende resultater som input til det endelige design af det pivotale fase III studie.
 FimaVACC resultater ventes i 1.halvår
FimaVACC resultater ventes i 1.halvår
PCI Bioetch har tidligere også iværksat fase I forsøg med en beslægtet teknologi, fimaVACC, som påtænkes at anvendes til at stimulere et T-celle baseret immunrespons i kombination med terapeutiske cancervacciner. I første omgang optages 80 raske personer med henblik på at kortlægge fimaVACCs evne til at stimulere et T-celle respons. I september 2017 kom den første melding fra studiet, som lyder på, at man har set et tilfredsstillende immunrespons i de første 70 optagne raske testpersoner. Bemærkelsesværdigt er desuden, at det største immunrespons sås på de laveste testede doser, hvilket åbner op for at man kan gå endnu længere ned i dosis i kommende forsøg. Der ventes endelige og mere detaljerede resultater fra fase I studiet i 1.halvår 2018.
I december 2016 indgik PCI Biotech en aftale med en ikke-offentliggjort top-10 pharma selskab omkring evaluering af PCI Biotechs tredje teknologiplatform fimaNAc, hvor omdrejningspunktet er nucleic acid baserede drugs. Aftalen har til hensigt at fastslå om fimaNAc-platformen virker synergistisk med pharma-selskabets egen teknologiplatform. I Q3 2017 er man nu gået i gang med at teste FimaNAc i dyremodeller (in vivo).
 Få kurstriggere i 2018
Få kurstriggere i 2018
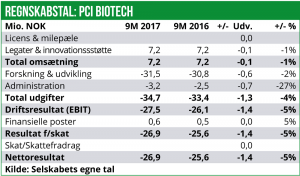
PCI Biotechs regnskab for 9M 2017 blev fremlagt i slutningen af november 2017, og viste et EBIT-underskud på ca. 27 mio. NOK, hvilket er på niveau med underskuddet i 9M 2016.
Der er i perioden 1-3. kvt. 2017 registreret omsætning på ca. 7 mio. NOK, hvilket stammer fra udviklingsstøtte fra blandt andet The Research Council of Norway, målrettet et proof-of-concept studie for FimaVACC-teknologien. The Research Council of Norway gav i februar 2017 PCI Biotech udviklingsstøtte på i alt 13,8 mio. NOK over en 3½ årig periode.
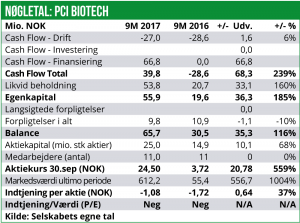
I januar 2017 gennemførte PCI Biotech desuden en emission med fortegningsret for eksisterende aktionærer. I alt er 10 mio. nye aktier udstedt til kurs 7,00 NOK, og således med et samlet provenu på 70 mio. NOK. Emissionen var overtegnet med 110% og de to største aktionærer i PCI Biotech bakkede op og tegnede aktier. Ved udgangen af september 2017 var der 25,0 mio. aktier udestående i selskabet.
Kapitalberedskabet per 30. september 2017 var på knap 54 mio. NOK. Vi vurderer, at dette vil være tilstrækkeligt til at finansiere driften frem til og med udgangen af 2018. Det er dog ganske sikkert, at PCI Biotech vil få behov for yderligere kapitaltilførsel for at man kan nå i mål med det afsluttende fase III fimaCHEM studie.
Med den seneste tids stigninger i aktiekursen (lukkekurs 55,70 NOK onsdag d. 10.januar) er PCI Biotech netop nu prissat til en markedsværdi på 1,4 mia. NOK. Aktien handles dermed til ca. 25 gange cash og pipelinens nutidsværdi sættes til 1,35 mia. NOK. Umiddelbart finder vi værdisætningen ganske høj, særligt i betragtning af, at der ikke er de helt store kurstriggere lige om hjørnet. Vi vurderer således, at aktien allerede har taget forskud på forventningen om fase III opstart med fimaCHEM til sommer.
Aktien er også gået igennem vores eksisterende kursmål på 40 NOK, som vi satte i januar 2017 da aktien lå i kurs 17,80 NOK. Eneste kurstrigger i de kommende måneder vil være dataaflæggelsen fra fase I studiet med fimaVACC, men vi ser ikke den helt store værdiskabelsen her, da forsøget foretages i raske individer.
Desuden bør man som investor være opmærksom på, at selskabet får behov for yderligere kapitaltilførsel inden for ganske få kvartaler, med mindre man kan lande en stor international licens-aftale på fimaCHEM. Vi tvivler umiddelbart på, at dette vil være muligt, om end vi anerkender, at det har skabt værdi, at man fået tildelt Orphan Drug Status af FDA samt at man formentlig kan nøjes med et ganske lille fase III forsøg med estimeret 50-100 patienter.
Vi hæver vores eksisterende kursmål fra 40 NOK til 50 NOK per aktie på 12 måneders sigt, men sænker vores anbefaling fra Køb til Neutral.
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her