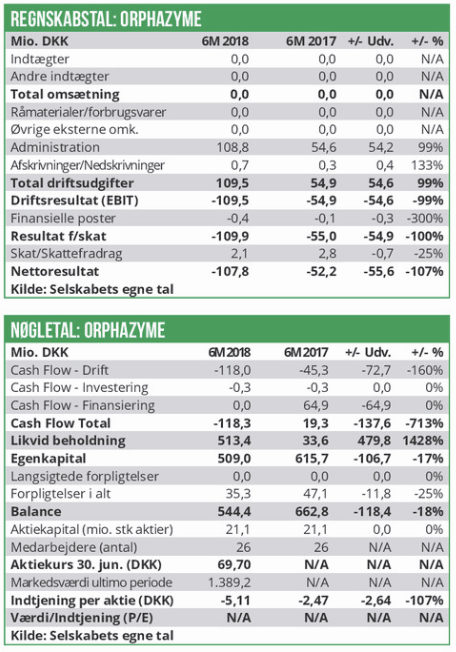
Aktien steg 35%, da selskabet onsdag offentliggjorde yderligere data fra arimoclomol NPC studiet, hvor top line data i september 2018 skuffede. De mere detaljerede kliniske data og biomarkør data styrker nemlig troen på, at arimoclomol alligevel kan godkendes uden yderligere studier.
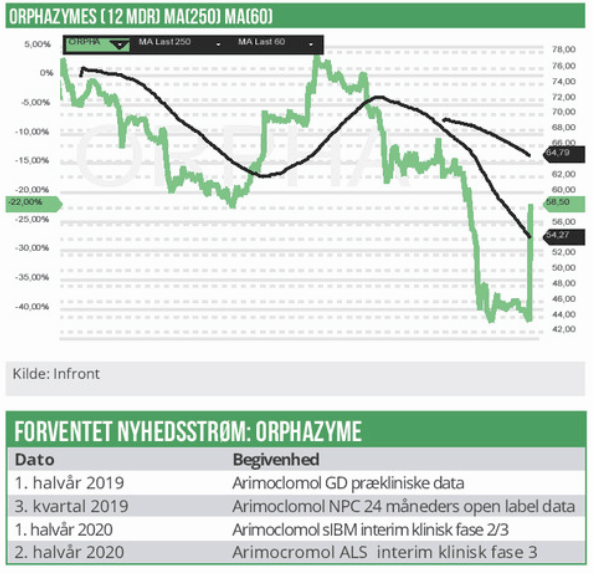
Orphazyme’s udviklingsportefølje er udelukkende baseret på arimoclomol, og derfor reagerer aktiemarkedet følsomt på data fra Niemann-Pick disease Type C (NPC) studiet, selvom indikationen er den mindste i udviklingsporteføljen. Onsdagens udmelding inkl. de mere specifikke planer om en NPC-registreringsansøgning styrker naturligt markedets tiltro til arimoclomol-udviklingsporteføljens potentiale.
NPC data måske gode nok til ansøgning
Orphazyme offentliggjorde klinisk fase 2/3 top-line data i september sidste år, som skuffede ved ikke at indfri det primære endpoint. Der er tale om et mindre studie med 50 patienter. I mindre kliniske studier på sjældne sygdomme er der ofte en relativt stor risiko for, at effektdata ikke er konklussive pga. varians i patientprofilerne, og det har formentlig også spillet en rolle i NPC-studiets udfald. Onsdagens opdaterede kliniske effektdata viser tydelige tegn på, at arimoclomol patientgruppen har fået behandlingseffekt i sammenligning med placeboarmen.
Målt på NPC-CSS-skalaen var effekten især mærkbar hos patienter ældre end 4 år (som det også fremgik af de tidligere top-line data) og hos patienter på miglustat (p=0.0071). Der registreredes ingen effekt i arimoclomol armen kontra placeboarmen på det sekundære kliniske effektmål (CGI-I skalaen, p=1). Orphazyme bemærker dog, at hos patientgruppen med svær progressiv udvikling var arimoclomol patienterne underrepræsenteret i forhold til placebogruppen (10,7% mod 26.7%). Data fra biomarkører som HSP70, kolesterol og oxysterol underbygger hypotesen om arimoclomols virkningsmekanisme. Der kan forventes 24 måneders data fra det igangvæ-rende 12 måneders open-label studie i 3. kvartal i år. Orphazyme vil nu forberede registreringsansøgningen forud for et forventet møde med FDA og EMA medio året, som skal afklare den videre regulatoriske proces. Selve ansøgningen forventes indsendt i 1. halvår 2020, lidt senere end tidligere forventet. Ved en evt. godkendelse vil Orphazyme modtage en priority review voucher, som må forventes at have en værdi på et 3-cifret mio. beløb.
Arimocromol tung pipeline
Orphazyme fokuserer på sjældne sygdomme, som har stor bevågenhed i biotekindustrien og hos investorerne. Pga. manglen på effektiv medicinsk behandling af patienter med sjældne sygdomme er prisen på den type medicin ofte høj. Satsningen på sjældne sygdomme kan derfor være en lønsom strategi fordi udviklings- og distributionsomkostninger er relativt lave.
Udviklingsporteføljen med arimocromol indeholder to kliniske projekter indenfor neuromuskulære sygdomme og to indenfor lysosomale sygdomme.
Indenfor Sporadic inclusion body myositis (sIBM) har Orphazyme igangsat et pivotalt randomiseret dobbeltblindet placebo kontrolleret fase 2/3 studie med 150 patienter. Det primære kliniske effektmål baserer sig på forbedringer af sygdomsforløbet målt via IBM-FRS-skalaen. Der er tale om et 20 måneders studie med 12 måneders interim data. Interim data forventes offentliggjort i H1 2020.
Sandsynligheden for at arimocromol sIBM studiet falder positivt ud understøttes af opnået proof of concept i et tidligere klinisk fase 2 studie med 24 patienter. Efter 8 måneder var der i behandlingsgruppen en stabilisering af sygdomsudviklingen i 86% af patienterne mod 25% i placebogruppen. Der er ikke mange potentielle konkurrenter i feltet, som bl.a. omfatter Regenerons REGN2477+REGN1033 i klinisk fase 2, hvor et af de sekundære effektmål er baseret på IBM-FRS-skalaen med opstart 2019. Der har været adskillige fejlslagne sIBM udviklingskandidater herunder bimagrumab og rapamycin. sIBM er det vigtigste udviklingsprojekt i værdiansættelsen af Orphazyme. Indenfor amyotrophic lateral sclerosis (ALS) har Orphazyme igangsat et fase 2/3 randomiseret dobbeltblændet placebo studie med 212 patienter. Selskabet forventer at offentliggøre interim data i 2. halvår 2020 og fuldt datasæt i første halvår 2021. Man har tidligere foretaget et mindre 36 patient SOD1 (SOD1 mutationer)-ALS POC fase 2 studie, hvor effekten på alle kliniske målparametre virkede lovende inkl. overlevelse målt ved hazard ratio.
Der er kun få konkurrerende lægemiddelkandidater i udvikling og mange ALS-udviklingskandidater har fejlet. Selvom ALS-indikationen rummer et meget større omsætningspotentiale end NPC er værdiansættelsen ikke tilsvarende høj, fordi vi pt. kun har sat en sandsynlighed for godkendelse på 40%.
Indenfor Gaucher disease (GD) påbegyndtes et fase 2 dosis-respons PK-PD-studie i Indien i 3. kvartal 2018. 40 patienter med GD 1 og 3, som ikke tidligere har modtaget behandling deltager i studiet. Data fra studiet forventes klar i løbet af 1.halvår i år.
Værdiansættelse
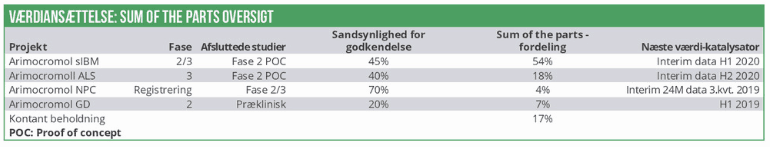
Arimoclomol indikationerne er som nævnt alle områder med et behov for nye medicinske behandlingsmuligheder, og en relativt høj prisfastsættelse er sandsynlig. Eksempelvis blev Biomarins seneste produkt Brineura (til den sjældne neuromuskulære sygdom Batten’s disease) lanceret i 2017 til en vejledende behandlingspris på 700.000 USD pr. år. Den årlige behandlingspris for de 10 bedst sælgende orphan drugs i 2017 på det amerikanske marked med et patientunderlag under 10.000 varierer fra 100.000 USD til 500.000 USD. Prisintervallet for arimoclomol på det amerikanske marked anslås at ligge i intervallet 150.000 -200.000 USD afhængig af indikation. De estimerede sandsynligheder for succes på de enkelte indikationer baserer sig på de historiske succesrater for lægemiddelkandidater til behandling af sjældne sygdomme (Orphan drugs) på det autoimmune- og inflammatoriske område. Sandsynligheden for at arimoclomol NPC bliver godkendt i USA og EU er sat til 70%. Det kan på trods af de seneste kliniske data dog stadig ikke udelukkes, at sundhedsmyndighederne vil kræve et udvidet arimoclomol NPC registreringsstudie.
Erfaringsmæssigt bliver biotekselskaber, hvor udviklingsporteføljen baserer sig på det samme aktive stof, uforholdsmæssigt hårdt ramt på aktiekursen, hvis det første registreringsstudie på det pågældende aktive stof fejler. For et biotekselskab, hvor alle udviklingsprojekter baserer sig på det samme aktive stof er udfaldet af det første registreringsstudie derfor særlig kritisk. Det er derfor positivt, at der er overvejende sandsynlighed for, at arimoclomol NPC bliver godkendt.
Den sandsynlighedsvægtede DCF-værdiansættelse i vor basisscenarie er 102 kr. pr aktie. Med en markedsværdi på 1.180 mio. kr. (inkl. kassebeholdningen) ved dagens kurs er Orphazyme prisfastsat over gennemsnittet for fase-3 biotekselskaber noteret på Nasdaq, dvs. selskaber med mindst én fase-3 udviklingskandidat.
Det likvide beredskab på 365 mio.kr. (17% af sum of the parts) forventes at række frem til begyndelsen af 2020 med en forventet stigende burn-rate i 2019 og 2020.
De kliniske data og biomarkør data fra NPC-studiet understøtter værdien af Orphazymes udviklingsportefølje. Derudover er der flere ikke alt for fjerne vigtige katalysatorer (kurstriggere), hvoraf den vigtigste vurderes at være arimoclomol sIBM fase 2/3 data i første halvår 2020. Vi sætter et 12 måneders kursmål til 80 kr., hvilket berettiger til en købsanbefaling.
Kurs på anbefalingstidspunkt: 55 kr.
Kurstarget: 80 kr. (12 mdr.)
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her