Ugens grafik stammer fra det ansete markedsresearchfirma IQVIA, som derudover også med egne ord er verdens største CRO, dvs. organisation, der på kontraktbasis gennemfører kliniske studier. Selskabet er i øvrigt børsnoteret med en markedsværdi på 35 mia. USD og omsætter for 15-16 mia. USD med et overskud på lidt over 1 mia. USD.
I disse Trump-tider er det ganske passende med en overskrift som America first, fordi den illustrerer, hvad der er på spil i dagens grafik, som stammer fra en ny IQVIA-rapport.
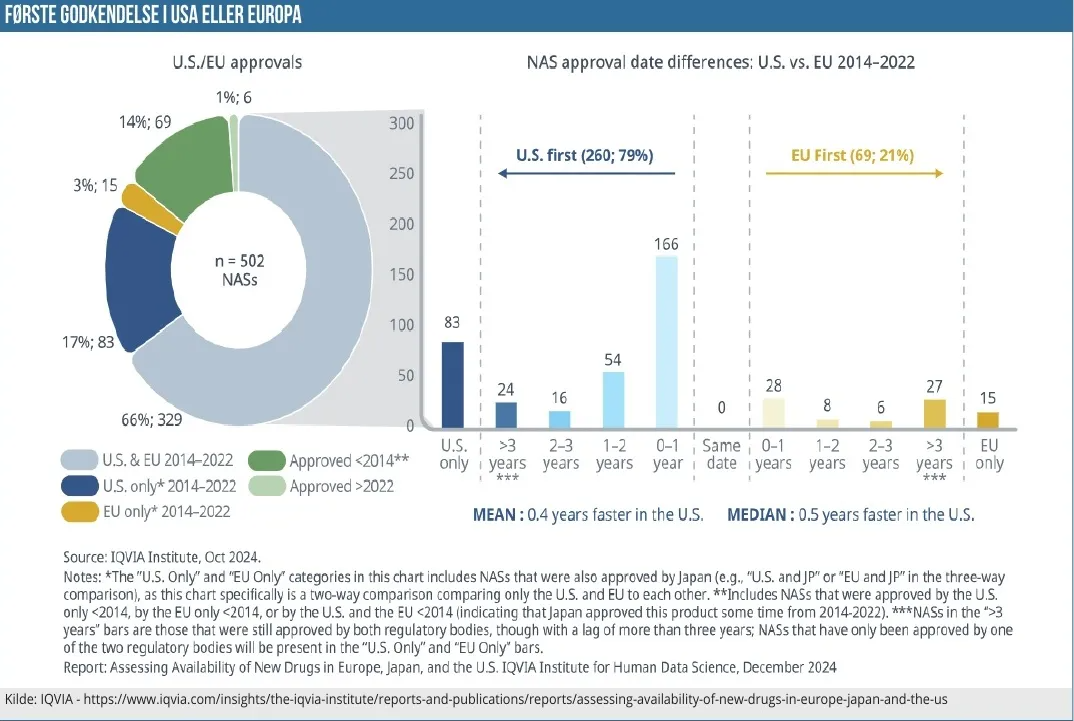
Grafikken til venstre viser antallet af godkendelser af nye lægemidler (NAS – Novel active substances) og fordelingen af disse mellem US og EU. Majoriteten af de 502 lægemidler, der indgår i oversigten, har opnået godkendelse i både EU og USA i perioden 2014-2022. Det er 329 lægemidler, der har opnået dette, mens 83 kun er godkendt i USA og 15 kun i EU.
I vores øjne er det dog grafikken til højre, der er mest interessant. Den går nemlig et spadestik dybere med disse 329 nye lægemidler med ”dobbelt-godkendelse” og ser nærmere på tidsfaktoren for godkendelsen. Den tomme, midterste del af grafikken illustrerer datoen, hvis et lægemiddel blev godkendt på samme dato i begge områder. Til højre ser vi de få (869) lægemidler, der blev godkendt i EU først, og hvordan de fordeler sig tidsmæssigt. F.eks. blev 8 lægemidler godkendt 1-2 år førend USA. Til venstre for midten i det blå område har vi samme fremgangsmåde, blot for de 260 lægemidler der blev godkendt først i USA.
I relative termer svarer de 260 til, at 79 % af de nye lægemidler blev godkendt i USA først, mens kun 69 opnåede godkendelse i EU først. Det er ikke en revolutionerende nyhed i sig selv, men det er altid godt med mere håndfast data, der understøtter den udbredte holdning, at USA altid er det forjættede land og næsten altid det første kommercielle mål, når det kommer til lægemiddeludvikling. Processen og adgangen til markedet er hurtigere der – og måske vigtigst af alt er priserne som regel også bedre – men det skal vi nok se på i en grafik en anden dag.
Median og gennemsnit peger på, at et nyt lægemiddel typisk bliver godkendt op mod ½ år før i USA. Og det leder videre til den næste grafik, som er fra samme IQVIA-rapport. Grafikken viser den gennemsnitlige tid fra godkendelse og frem til lægemidlet er tilgængeligt på markedet.
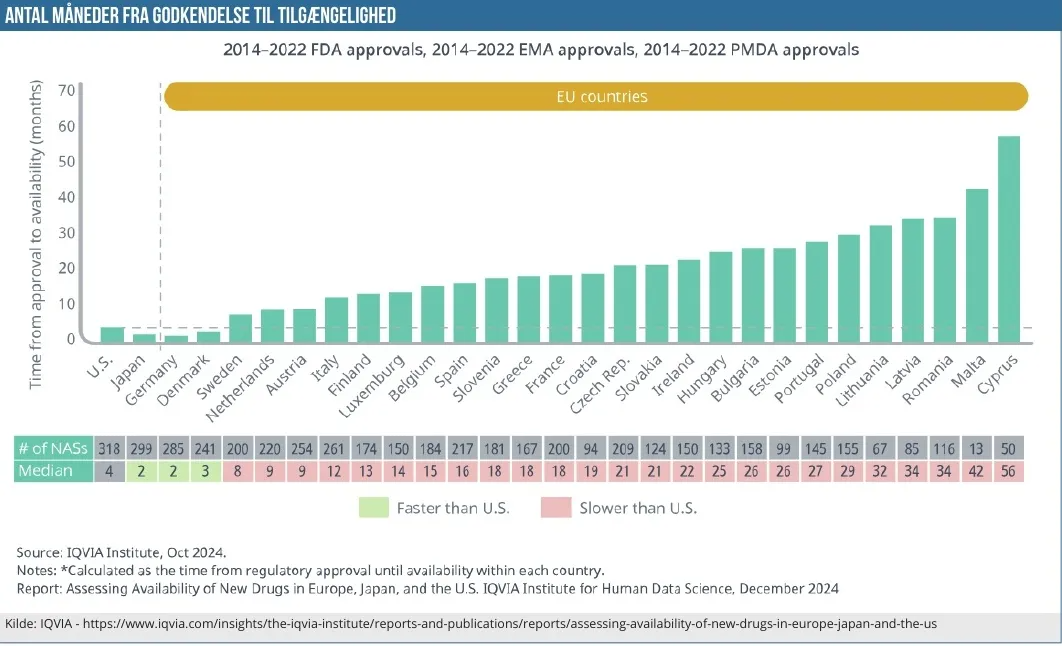
Tilgængelighed defineres som, hvornår der opnås tilskud (”…it achieves payer coverage within a given country, can vary by product, country, and (in the U.S.), by benefit type and payer channel”).
Her ser vi, at kun 2 EU-lande er hurtigere end USA, og det er Tyskland og Danmark. USA har en median på 4 mdr., mens Tyskland og Danmark ligger på 2 hhv. 3 mdr. Japan ligger i øvrigt også pænt med en median på 2 mdr. De resterende 25 lande varierer fra 8 og helt op til 56 mdr. på Cypern.
Årsagerne er mange, da der bortset fra den regulatoriske godkendelse hos det europæiske lægemiddelagentur EMA ikke er nogen central europæisk proces for opnåelse af tilskud. Der skal forhandles priser og tilskud i hvert enkelt land, og som det også anføres i rapporten, er der mange faktorer, der kan spille ind på, hvor hurtigt et lægemiddel opnår tilskud. Tidskrævende faktorer kan være prisforhandlingen i sig selv, budget-restriktioner, ressource-mangel og en række andre faktorer, herunder en vurdering af om det særligt for dyre nye mediciner er ”pengene værd” at give tilskud.
Uddrag fra IQVIA’s rapport kan læses på linket nedenfor, hvor man også kan downloade en fuld version mod afgive visse personlige data.
Steen Albrechtsen
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her