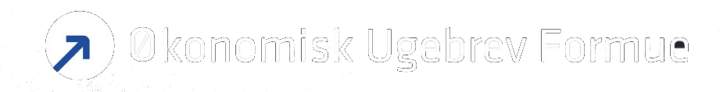Det positive resultat fra Tarpeyo part B studiet, der netop er fremlagt, er vigtigt for Tarpeyos videre succes. Lanceringen i USA er indtil nu gået godt og salget kan nu få yderligere medvind. Som et modent biotekselskab er Calliditas en attraktiv investeringsmulighed i et marked, hvor investorerne bortvælger de mere risikable, umodne og kapitalhungrende biotekselskaber. Aktien er steget med 30 % i år med yderligere potentiale, selvom Tarpeyo nu får konkurrence fra Traveres nyligt godkendte Filspari. Kursmålet hæves med uændret købsanbefaling.
Resultaterne fra det opfølgende Tarpeyo NefIgArd fase 3 Part B studie efter det succesfulde Part A studie var vigtige, omend ikke voldsomt overraskende efter de positive Part A data. Det primære clinical endpoint i Part A studiet var ændringen i proteinuri målt ved UPCR (forhøjet protein i urinen) hos IgAN diagnosticerede nyrepatienter.
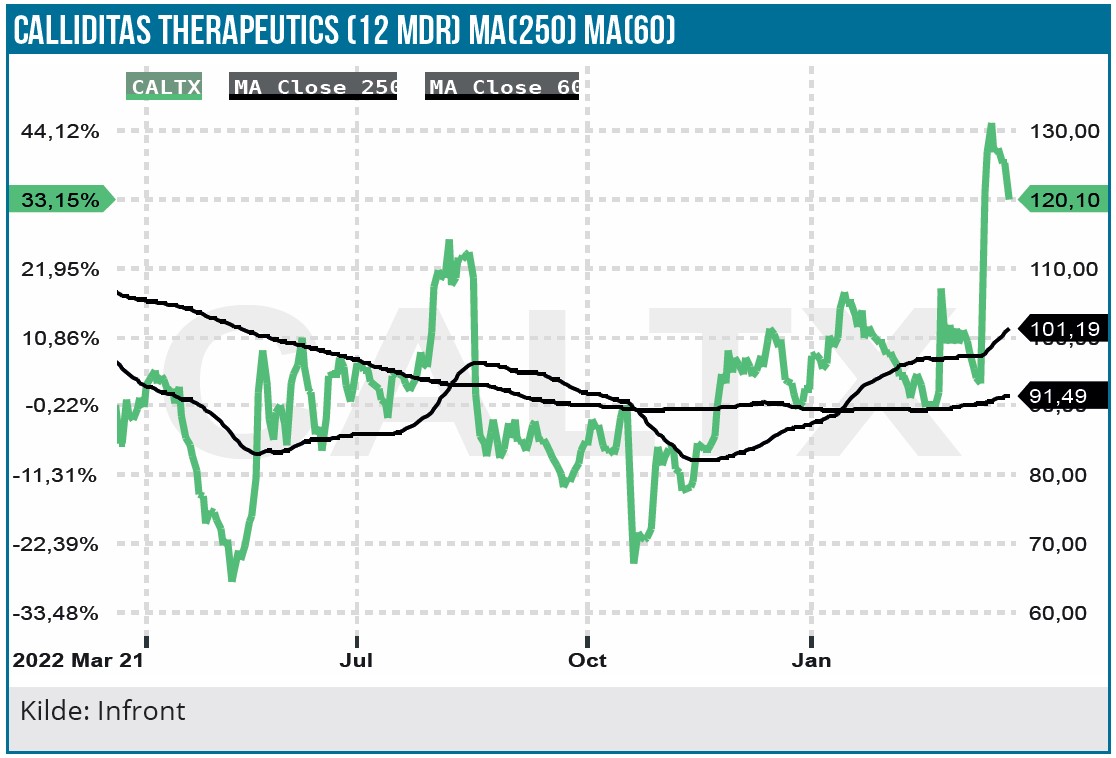
Selvom UPCR er en generelt anerkendt markør for nedsat nyrefunktion, krævede FDA yderligere dokumentation for Tapeyos behandlingseffekt via Part B studiet. Part B studiet, som er et opfølgende studie over 2 år efter 9 måneders daglig behandling med Tarpeyo, havde nyrefiltreringshastigheden eGFR som primært clinical endpoint, og det anses som et mere solidt mål for nyrefunktionen.
Det 364 patient store placebokontrollerede studie af IgAN-patienterne viste en statistisk signifikant behandlingseffekt med Tarpeyo, hvor bivirkningsprofilen var på linje med hvad man så i Part A studiet. De gode data betyder med al sandsynlighed, at accelerated approval FDA-godkendelsen bliver vekslet til en fuld Tarpeyo FDA-godkendelse.


Ny konkurrent på banen med stærke data
I februar fik Travere Therapeutics’ Filspari FDA accelerated approval i behandlingen af IgAN nyrepatienter og bliver derfor en konkurrent til Tarpeyo. Filspari har en anden virkningsmekanisme end Tarpeyo, som undertrykker patientens immunrespons. Filspari blokerer endotel-1 og angiotensin II, som forstærker beskadigelsen af nyrernes filtreringsbarriere. Interim effektdata fra Filspari PROTECT fase 3 studiet var positive. Der er tale om et 36 ugers head-to-head dobbeltblindet fase 3 studie, hvor Filspari sammenlignes med den blodtrykssænkende medicin ibesartan.
Efter 36 ugers behandling viste Filspari en positiv behandlingseffekt. Reduktionen i proteinuri (UPCR) var 49,8 % mod en behandlingseffekt med ibesartan på 15 %. Sammenlignet med Tarpeyo part A virker data gode. I part A var UPCR reduktionen efter 9 måneder 33,6 % mod placeboeffekten på 5,2 %. Da Tarpeyos behandlingseffekt var voksende fra 3 måneder til 12 måneders behandling, er forskellen formentlig endnu mere markant efter 3 måneders Tarpeyo behandling. Som altid skal sammenligninger på tværs af studier imidlertid tages med forbehold.
Efter FDA accelerated approval fortsætter Travere Protect studiet frem til 110 ugers behandling med henblik på at få fuld FDA-godkendelse via eGFR data. Data vil derfor først være klar i 2025, og Calliditas står derfor til at få et betydeligt forspring, når det gælder fuld FDA produktgodkendelse, som Calliditas forventer i 2024.
Tarpeyo kan også have en fordel, når det gælder bivirkninger, da Filspari har fået en black box warning fra FDA. FDA har derfor pålagt Travere at køre et REMS overvågningsprogram, som bl.a. inkluderer en månedlig levermonitorering og undersøgelse af gravide kvinder pga. risiko for fosterskader.
Der satses hårdt i markedsføringen
Både Travere og Calliditas er rustet til tænderne, når det gælder markedsføringen, som bl.a. omfatter medical affairs servicering af de ca. 6.000 amerikanske nefrologer.
Travere har fordel af, at selskabet allerede har produktet Thiola mod nyresten på markedet og dermed forbindelse til ca. 2.000 nefrologer. Traveres CEO Eric Dube har derfor udtrykt stor tiltro, at selskabet kan eksekvere effektivt i lanceringsfasen, hvor Travere har et 80+ salgsteam, mens Calliditas har 60 lægemiddelkonsulenter.
Calliditas’ omkostning til salg, administration og markedsføring er steget kraftigt i 2022 i forbindelse med lanceringen, men stadig væsentligt lavere end Traveres.
Med et stort behov for ny medicin i behandlingen af IgAN, er der sandsynligvis mulighed for, at begge lægemidler opnår et betydeligt salg.
Opjustering af Tarpeyo-salgsestimaterne
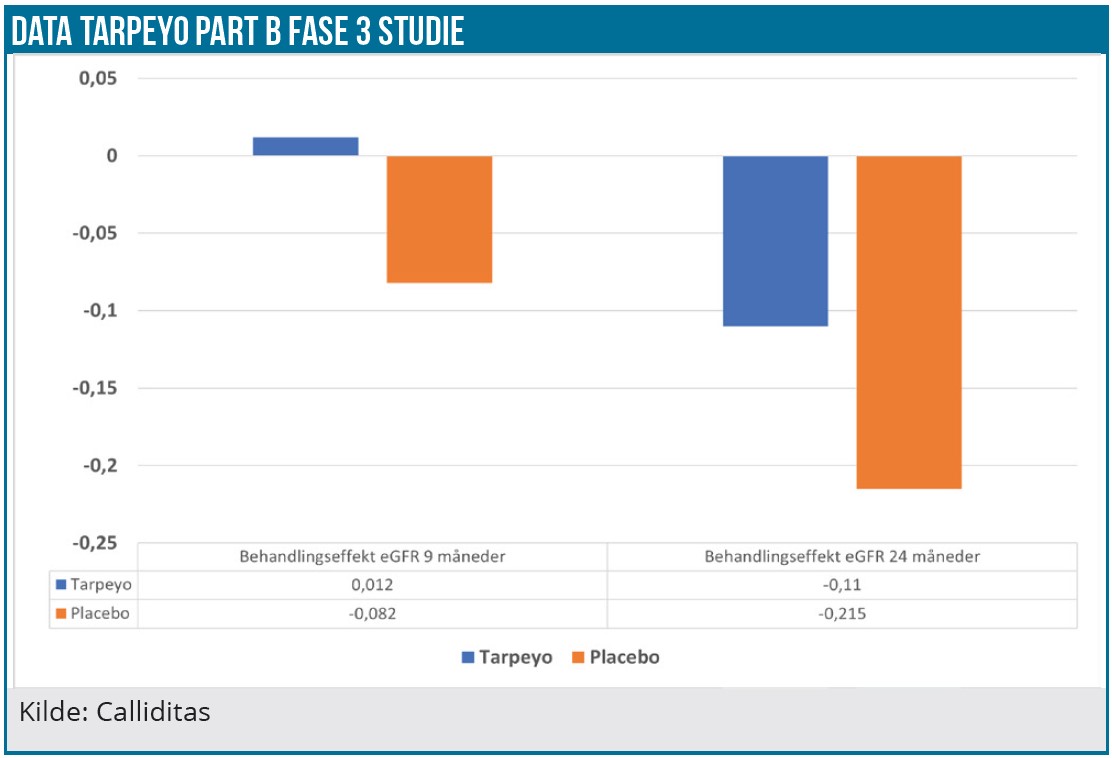
Når biotekselskaber lancerer deres første produkt, skuffer de tit markedets forventninger. Det er ikke tilfældet med Tarpeyo, som det fremgår af tabellen.
Calliditas guider en kraftig stigning i salget i 2023 med en forventning om et Tarpeyo salg på 120-150 mio. USD, og vi har derfor opjusteret vores Tarpeyo salgsestimater. Tarpeyo USA-salget i 2030 estimeres til 370 mio. USD (3.840 mio. SEK) med en markedsandel på 20 %, hvilket også levner god plads til Filspari og eventuelle andre konkurrenter. Trods opjusteringen kan det estimat vise sig konservativt.
2030-estimatet på det totale Tarpeyo-salg inkl. salget via licenspartneren Stada i Europa (Kinpeygo er lægemidlet navngivet her), Kina og Japan er 5.080 mio. SEK. Kinpeygo-salget er kommet langsomt i gang med royaltyindtægter på 2 mio. SEK i 4. kvartal, så her skal licenspartneren Stada oppe sig. Nefecon er endnu ikke godkendt i Kina og Japan, men de kinesiske sundhedsmyndigheder har for nyligt accepteret licenspartneren Everest Medicines’ godkendelsesansøgning.
Tarpeyo USA-salg 2022
Mht. pipelinen har det lange udsigter med data fra NOX1/4-hæmmeren setanaxib fase 2b/3 studiet i behandlingen af leversygdommen PBC, hvor interim data forventes i 2024. Efter et tidligere fejlslagent setanaxib PBC-studie er det noget usikkert, om studiet lykkes denne gang, jfr. vor tidligere analyse. Derimod kommer biomarkørdata fra fase 2 setanaxib proof-of-concept studiet i indikationen hoved og halskræft (SCCHN) i år. Keytruda (pembrolizumab) har fået voksende betydning i behandlingen af SCCHN i de seneste år, og fase 2 studiet afprøver, om setanaxib kombineret med Keytruda forstærker behandlingseffekten i forhold til Keytruda monoterapi.
Virkningsmekanismens rationale er, at NOX-4 er kraftigt overudtrykt i cancer associerede fibroblaster, som medvirker til at afskærme tumormikromiljøet fra de meget effektivt virkende tumorcelledræbere, CD8+tumor infiltrerende lymfocytter. Det er derfor formodningen, at NOX-4 targeterende medicin (som setanaxib) forbedrer immunterapiens behandlingseffekt ved kombinationsbehandling.
Fortsat anbefalingen KØB
På trods af stigende omkostninger til salg og markedsføring var Calliditas overskudsgivende i 4. kvartal. Udover fremgang i Tarpeyo-salget havde milepælsbetalinger fra licenspartnerne på 258 mio. SEK positiv resultateffekt. Mere vigtigt er dog, at vi i 2023 og fremefter forventer, at selskabet bliver overskudsgivende.
Vigtigste kurstriggere i 2023 er Tarpeyo og Kinpeygo salget og SCCHN setanaxib biomarkør fase 2 data. Trods forventning til markant stigende omkostninger er der alligevel udsigt til en kraftig indtjeningsvækst pga. den positive udvikling i Tarpeyo-salget.
Det er desuden positivt, at Calliditas’ ledelse ønsker ejerskab i virksomheden. CEO Renée Aguiar-Lucander øgede i december sidste år sin Calliditas eksponering og ejer 643.000 aktier samt 591.000 optioner.
DCF nutidsværdien i vores model ligger nu på 169 SEK/aktie (WACC 14 %), og en P/S-2027 på 2,6 peger mod fortsatte kursstigninger understøttet af en fremgang i Tarpeyo-salget.
Anbefalingen er derfor uændret KØB og 12 måneders kursmålet hæves fra 140 SEK til 180 SEK.
Lars Hatholt
Kurs på anbefalingstidspunkt: 122,5
Kursmål 12 måneder: 180 SEK (tidligere 140 SEK)
Analysedato: 21. marts 2023
Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her