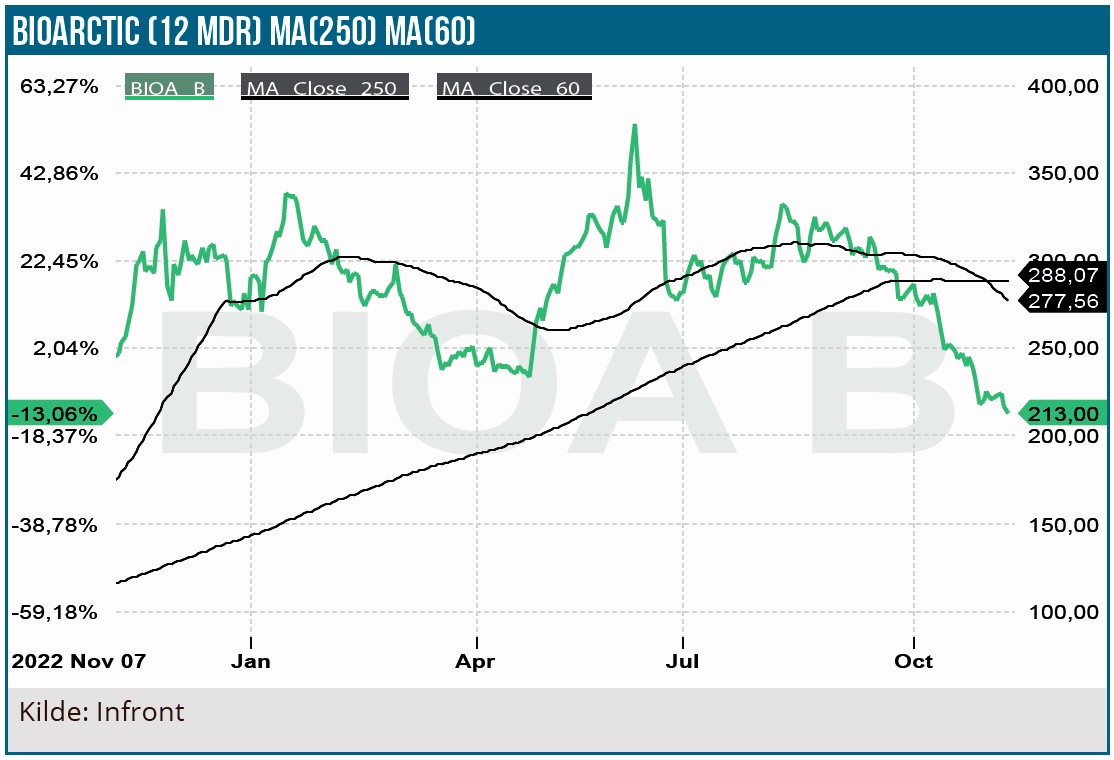
Efter godkendelsen af Alzheimers lægemidlet Lequembi (lecanemab) i USA og Japan med en forventet EU-godkendelse i 2024 skal markedspotentialet nu stå sin prøve. Aktiekursen har været meget volatil i år og har i årets løb mistet 28 % efter den markante kursstigning i 2022 ovenpå de positive Lequembi fase 3 data. Det tegner til en solid indtjeningsvækst i de kommende år med udsigten til, at Lequembi opnår blockbuster status. Efter kurskorrektionen ændres anbefalingen fra Neutral til Køb.
BioArctic er en af succeshistorierne i nordisk biotek med udviklingen af Lequembi, som har potentiale til at blive et banebrydende lægemiddel i behandlingen af Alzheimers, dvs. en decideret blockbuster.
BioArctic har udlicenseret lecanemab til Eisai og Biogen. Eisai står for den kliniske udvikling, dialogen med FDA, CMS (Medicare og Medicaid) og kommercialiseringen, mens Biogen har ansvaret for produktionen af lecanemab.
Lecanemab Clarity AD fase 3 studiet med 1.795 patienter viste en reduktion i det kognitive fald målt ved CDR-SB1 skalaen (Clinical Dementia Rating-Sum of Boxes). Efter 18 måneders behandling var det kognitive kliniske fald i behandlingsarmen 27 % mindre i gennemsnit sammenlignet med placebogruppen, som var statistisk signifikant. Alle sekundære kliniske endpoints klarede lecanemab også med statistisk signifikans, herunder behandlingens effekt på amyloidplaques i hjernen målt via PET scanning og den kognitive udvikling målt ved flere af de øvrige demensmålingsskalaer
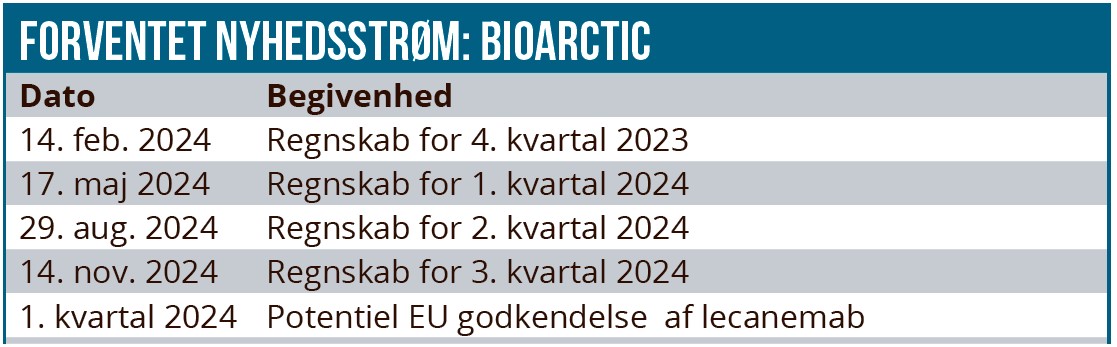
BioArctic står derfor til at få betydelige licens- og milepælsindtægter fra samarbejdspartnerne, hvis Lequembi som forventet bliver en succes. Lequembi blev godkendt i USA i starten af året og senere på året i Japan. Godkendelse i EU kan forventes i 1. kvartal 2024.
Markedet har tidligere haft mest tiltro til Eli Lillys konkurrerende produkt donanemab, men Lequembis gode kliniske resultater har bragt produktet i førerposition foran Eli Lillys og Roches Alzheimers lægemidler, som befinder sig i fase 3. Alle har ensartet virkningsmekanisme, dvs. det er monoklonale antistoffer, som virker imod beta-amyloid (Aβ) i hjernen. Det er et protein, som klumper sig sammen med tiden med plakdannelser i primært den del af hjernen, som vedrører hukommelsesfunktionen, og det svækker over tid patientens hukommelse.
Behovet for effektiv medicin til behandling af demens er enormt, men som et nyt behandlingskoncept er spørgsmålet hvor stort? Aβ produkter har tidligere skuffet forventningerne med Biogen/Eisais aducanumab som det seneste eksempel, så der er formentlig opbygget en del skepsis til produkterne blandt neurologerne. Der har også været kritiske røster omkring prissætningen af Lequembi, hvor listeprisen er sat til 26.500 USD for en årlig behandling. Dog er prisen lavere end Biogens fejlslagne aducanumab, som indledningsvist blev prissat til 56.000 USD per år for efterfølgende at blive reduceret til 28.200 USD. Det tegner dog til, at de amerikanske læger har taget Lequembi til sig, da 60 % af de største receptudskrivere er klar til at behandle med lægemidlet og også er enige om anvendelsen af CDR-SB-markøren til diagnosticering. Der er en vis lag-effekt på omkring 3 måneder fra, at klinikkerne og hospitalerne bestemmer sig for behandling med Lequembi, til behandlingen finder sted. Processen skal i gang med patientvisitation hos en neurolog for diagnose (og de er typisk travlt beskæftiget i USA), derefter skal patienten sikres plads på et infusionscenter (Lequembi antistoffet gives intravenøst), og endelig skal der reserveres tid til flere PET-skanninger under behandlingsforløbet for at overvåge evt. ARIA/bivirkninger i hjernen.
Indtil september har Lequembisalget derfor været beskedent, men vil formentlig begynde at rykke på sig i de kommende måneder. Lequembi har fået godkendelse af den amerikanske sygesikring Medicare & Medicaid (MMS), og MMS har også accepteret refusion på PET-skanning. Biogen/Eisai forventer, at de amerikanske læger i 1. kvartal 2024 vil have udskrevet 10.000 recepter. Det svarer til en markant stigning i salget, hvor der i oktober i år var 800 patienter i Lequembi behandling.
Nye versioner af Lequembi på vej i 2025
Lequembi behandlingen er forholdsvis omstændig, da patienten skal have injektioner i flere omgange intravenøst, hvor subkutan injektion vil være mindre behandlingskrævende og patientvenlig. Derfor har partneren Eisai udviklet en subkutan version, som blev præsenteret på Clinical Trials On Alzheimers Disease (CTAD) konferencen i oktober i år.
Sammenlignet med den intravenøse version har Lequembi subkutan fordel af forbedret behandlingseffekt, når det gælder fjernelse af Aβ plaks, forbedret farmakokinetik og uændret bivirkningsprofil herunder ARIA-E bivirkninger.
Eisai udvikler også en langtidsvirkende version (én gang månedligt). BioArctic sagde på onsdagens telefonkonference, at man forventer en lancering af de to nye Lequembi produktversioner i 2025. De nye produkter må forventes at tage en betydelig del af Lequembi salget i fremtiden og styrke produktets konkurrenceevne.
Betydeligt, men usikkert salgspotentiale
Der florerer mange estimater på Lequembi salget i markedet. Eisai har forventninger om, at Lequembi sælger for 7 mia. USD i 2030. Vi er knapt så optimistiske og har skåret estimatet til 6,3 mia. USD i 2030 mod tidligere 7,1 mia. USD. Heraf får BioArctic 5-10 % i royalty – det nøjagtige tal er ikke offentliggjort. Her har vi lagt os i midten med en gennemsnitsats på 8 %, hvor satsen formentlig vil være stigende med salgsudviklingen. I 2030 vil BioArctic med vores estimater få et Lequembi provenu på 532 mio. USD svarende til 5,8 mia. SEK.
Markant indtjeningsvækst i de kommende år
Den forventede fremgang i Lequembi salget betyder en markant indtjeningsvækst i de kommende år, som for alvor sætter ind fra 2025. Derudover vil BioArctic få en betydelig milepælsbetaling, hvis Lequembi som forventet opnår EMA godkendelse i 2024. BioArctic skal i samarbejde med Eisai markedsføre Lequembi i Skandinavien, og selskabet forventer derfor, at SG&A omkostningerne fordobles i 2024/2025. Kassebeholdningen var ultimo 3. kvartal på 697 mio. SEK, og den inkluderer ikke en milepælsbetaling på 201 mio. SEK fra Lequembi samarbejdet med Eisai, som forfalder i 4. kvartal.
Anbefaling ændres fra Neutral til Køb
Efter kurskorrektionen ændres anbefalingen til KØB. Lequembi lanceringsforløbet i USA bliver afgørende for kursudviklingen. Udover Lequembi har BioArctic Parkinsons lægemidler exidavnemab i udvikling, som påbegynder fase 2 i 2024. Stoffet er et anti-alfasynuclein antistof, som tegner interessant, men vi tillægger det som fase 2 stof endnu ingen værdi i vores model.
Anbefalingen understøttes af nøgletallene i base case scenariet, hvor vi siden sidst har som nævnt har sænket salgsestimaterne en smule og tilpasset omkostningsestimaterne. Samlet set lander vi på en DCF nutidsværdi på 246 SEK (ved WACC 12 %) og en P/E-2025 på 15,7.
Lars Hatholt
Aktiekurs på anbefalingstidspunkt: 213 SEK
Kursmål: 270 SEK (12 mdr.)
Analysedato: 9. november 2023
Disclaimer: Læs her om ØU’s aktieanalyser

Intro-pris i 3 måneder
Få unik indsigt i de vigtigste erhvervsbegivenheder og dybdegående analyser, så du som investor, rådgiver og topleder kan handle proaktivt og kapitalisere på ændringer.
- Fuld adgang til ugebrev.dk
- Nyhedsmails med daglige opdateringer
- Ingen binding
199 kr./måned
Normalpris 349 kr./måned
199 kr./md. de første tre måneder,
herefter 349 kr./md.
Allerede abonnent? Log ind her